–Я—Б–Є—Е–Њ–ї–Њ–≥–Є—П –Є
–њ—Б–Є—Е–Њ—В–µ—А–∞–њ–Є—П
–°–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ
–њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞
| –С–Њ–ї–µ–Ј–љ—М
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ (—Б–Є–љ–Њ–љ–Є–Љ вАУ –і–µ–Љ–µ–љ—Ж–Є—П
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞) –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є
–љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Г—О —Д–Њ—А–Љ—Г –њ–µ—А–≤–Є—З–љ—Л—Е
–і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –і–µ–Љ–µ–љ—Ж–Є–є –њ–Њ–Ј–і–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞,
–Ї–Њ—В–Њ—А–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –њ–Њ—Б—В–µ–њ–µ–љ–љ—Л–Љ
–Љ–∞–ї–Њ–Ј–∞–Љ–µ—В–љ—Л–Љ –љ–∞—З–∞–ї–Њ–Љ –≤ –њ—А–µ—Б–µ–љ–Є–ї—М–љ–Њ–Љ –Є–ї–Є
—Б—В–∞—А—З–µ—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ, –љ–µ—Г–Ї–ї–Њ–љ–љ—Л–Љ
–њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –њ–∞–Љ—П—В–Є –Є –≤—Л—Б—И–Є—Е
–Ї–Њ—А–Ї–Њ–≤—Л—Е —Д—Г–љ–Ї—Ж–Є–є –≤–њ–ї–Њ—В—М –і–Њ —В–Њ—В–∞–ї—М–љ–Њ–≥–Њ —А–∞—Б–њ–∞–і–∞
–Є–љ—В–µ–ї–ї–µ–Ї—В–∞ –Є –њ—Б–Є—Е–Є—З–µ—Б–Ї–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –≤ —Ж–µ–ї–Њ–Љ, –∞
—В–∞–Ї–ґ–µ —В–Є–њ–Є—З–љ—Л–Љ –љ–∞–±–Њ—А–Њ–Љ –љ–µ–є—А–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е
–њ—А–Є–Ј–љ–∞–Ї–Њ–≤. |
 |
–≠—В–Є–Њ–ї–Њ–≥–Є—П –Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –Њ–≥—А–Њ–Љ–љ—Л–є –Њ–±—К—С–Љ
–љ–∞–Ї–Њ–њ–ї–µ–љ–љ—Л—Е –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–µ—Б—П—В–Є–ї–µ—В–Є—П –Ј–љ–∞–љ–Є–є –Њ
–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–љ–Њ–≤–∞—Е –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞,
–љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–Ј–љ–∞—В—М, —З—В–Њ —Н—В–Є–Њ–ї–Њ–≥–Є—П –њ–Њ–і–∞–≤–ї—П—О—Й–µ–≥–Њ
–±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—Б—В–∞–µ—В—Б—П –і–Њ —Б–Є—Е
–њ–Њ—А –љ–µ–Є–Ј–≤–µ—Б—В–љ–Њ–є. –Т —Б–≤–µ—В–µ —А–∞–Ј–≤–Є–≤–∞–µ–Љ–Њ–є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ
–≤—А–µ–Љ—П –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Ї–ї–Є–љ–Є–Ї–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є
–≥–µ—В–µ—А–Њ–≥–µ–љ–љ–Њ—Б—В–Є –±–Њ–ї–µ–Ј–љ–Є –≤–њ–Њ–ї–љ–µ –≤–µ—А–Њ—П—В–љ–Њ, —З—В–Њ —А–µ—З—М
–Є–і–µ—В –Њ–± —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ–∞—Е –і–µ–Љ–µ–љ—Ж–Є–Є
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞, –Ї–Њ—В–Њ—А—Л–µ —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –њ–Њ
–Њ–±—Й–Є–Љ –Є–ї–Є –і–∞–ґ–µ —В–Њ–ї—М–Ї–Њ –њ–Њ —З–∞—Б—В–Є—З–љ–Њ —Б–Њ–≤–њ–∞–і–∞—О—Й–Є–Љ
–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ, –њ—А–Є–≤–Њ–і—П—В –Ї
—Н–Ї–≤–Є—Д–Є–љ–∞–ї—М–љ—Л–Љ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ –≤ –≤–Є–і–µ –Њ–±—Й–µ–≥–Њ
—Б—В–µ—А–µ–Њ—В–Є–њ–∞ —А–∞–Ј–≤–Є—В–Є—П –±–Њ–ї–µ–Ј–љ–Є, —Б—Е–Њ–і—Б—В–≤–∞
–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Є –љ–µ–є—А–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є
—Д–µ–љ–Њ–Љ–µ–љ–Њ–ї–Њ–≥–Є–Є.
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –±–Њ–ї–µ–Ј–љ—М
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –≤–Ї–ї—О—З–∞–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є
–≥–µ—В–µ—А–Њ–≥–µ–љ–љ—Л—Е —Д–Њ—А–Љ. –Э–∞ –Њ—Б–љ–Њ–≤–µ –і–∞–љ–љ—Л—Е –±–ї–Є–Ј–љ–µ—Ж–Њ–≤–Њ–≥–Њ
–∞–љ–∞–ї–Є–Ј–∞, –Є–Ј—Г—З–µ–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–∞ –љ–∞—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є
—А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –∞–љ–∞–ї–Є–Ј–∞ –≥–µ–љ–Њ–≤, –≤–Њ–≤–ї–µ—З–µ–љ–љ—Л—Е –≤ –±–Њ–ї–µ–Ј–љ—М
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ (–Р.Roses –Є —Б–Њ–∞–≤—В., 1992; –Х.–Ш.–†–Њ–≥–∞–µ–≤, 1999),
–Њ–њ—А–µ–і–µ–ї–µ–љ –≤–Ї–ї–∞–і –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –≤
–њ–∞—В–Њ–≥–µ–љ–µ–Ј —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ
–Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ф–ї—П —Б–µ–Љ–µ–є–љ—Л—Е —Д–Њ—А–Љ —Б —А–∞–љ–љ–Є–Љ –љ–∞—З–∞–ї–Њ–Љ
–±–Њ–ї–µ–Ј–љ–Є (—Г—Б–ї–Њ–≤–љ–Њ –і–Њ 65 –ї–µ—В, –љ–Њ —З–∞—Й–µ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 40вАУ55
–ї–µ—В) —Е–∞—А–∞–Ї—В–µ—А–µ–љ –∞—Г—В–Њ—Б–Њ–Љ–љ–Њ-–і–Њ–Љ–Є–љ–∞–љ—В–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А
–љ–∞—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –њ—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П
–±–Њ–ї–µ–Ј–љ–Є —П–≤–ї—П–µ—В—Б—П –Љ—Г—В–∞—Ж–Є—П –≤ –µ–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–Љ –≥–µ–љ–µ.
–£–Ї–∞–Ј–∞–љ–љ—Л–µ —Д–Њ—А–Љ—Л —Б–Њ—Б—В–∞–≤–ї—П—О—В –ї–Є—И—М –љ–µ–±–Њ–ї—М—И—Г—О —З–∞—Б—В—М
(–і–Њ 10%) –њ–∞—В–Њ–ї–Њ–≥–Є–Є,
–Њ–±—К–µ–і–Є–љ—П–µ–Љ–Њ–є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–Њ–і —А—Г–±—А–Є–Ї–Њ–є
–±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞.
–Я—А–Є –±–Њ–ї–µ–µ —А–µ–і–Ї–Є—Е —Б–µ–Љ–µ–є–љ—Л—Е —Д–Њ—А–Љ–∞—Е —Б –њ–Њ–Ј–і–љ–Є–Љ (–њ–Њ—Б–ї–µ
65 –ї–µ—В) –љ–∞—З–∞–ї–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —В–Є–њ –љ–∞—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞–Ї –Њ–ї–Є–≥–Њ–≥–µ–љ–љ—Л–є (—Б –≥–ї–∞–≤–љ–Њ–є –Љ—Г—В–∞—Ж–Є–µ–є
–≤ –Њ–і–љ–Њ–Љ –Є–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –≥–µ–љ–∞—Е –Є –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Њ–љ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –≤ –і—А—Г–≥–Є—Е).
–Я–Њ –Љ–љ–µ–љ–Є—О —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ (–Х.–Ш.–†–Њ–≥–∞–µ–≤, 1999), —В–∞–Ї
–љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ —Б–њ–Њ—А–∞–і–Є—З–µ—Б–Ї–Є–µ —Б–ї—Г—З–∞–Є, –Ї –Ї–Њ—В–Њ—А—Л–Љ
–Њ—В–љ–Њ—Б–Є—В—Б—П –њ–Њ–і–∞–≤–ї—П—О—Й–µ–µ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б
–±–Њ–ї–µ–Ј–љ—М—О –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞, —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –±—Л—В—М
–Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –Љ—Г—В–∞—Ж–Є—П–Љ–Є –Є–ї–Є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–∞–Љ–Є –≤
–≥–µ–љ–∞—Е, –Њ–і–љ–∞–Ї–Њ –њ–∞—В–Њ–≥–µ–љ–љ–∞—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П
–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є –∞–љ–Њ–Љ–∞–ї–Є–Є —Г –љ–Є—Е –љ–∞—Е–Њ–і–Є—В—Б—П –њ–Њ–і
–≤–ї–Є—П–љ–Є–µ–Љ –і—А—Г–≥–Є—Е –≥–µ–љ–Њ–≤ –Є/–Є–ї–Є —Б—А–µ–і–Њ–≤—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤.
–Э–µ–і–∞–≤–љ–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –Њ–±–ї–∞—Б—В–Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є
–≥–µ–љ–µ—В–Є–Ї–Є –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –њ—А–Є–≤–µ–ї–Є –Ї
–Є–і–µ–љ—В–Є—Д–Є–Ї–∞—Ж–Є–Є —В—А–µ—Е –≥–µ–љ–Њ–≤, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞
—А–∞–Ј–≤–Є—В–Є–µ —Б–µ–Љ–µ–є–љ—Л—Е (—В.–µ.
–љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ-–Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е) —Д–Њ—А–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Э–∞ 21-–є —Е—А–Њ–Љ–Њ—Б–Њ–Љ–µ –ї–Њ–Ї–∞–ї–Є–Ј–Њ–≤–∞–љ –≥–µ–љ –∞–Љ–Є–ї–Њ–Є–і–љ–Њ–≥–Њ
–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–∞ (b-–Р–†–†); –љ–∞ 14-–є вАУ –≥–µ–љ-–њ—А–µ—Б–µ–љ–Є–ї–Є–љ-1 (PSN-1) –Є
–љ–∞ 1-–є —Е—А–Њ–Љ–Њ—Б–Њ–Љ–µ вАУ –њ—А–µ—Б–µ–љ–Є–ї–Є–љ-2 (PSN-1).
–Э–Њ—Б–Є—В–µ–ї–Є –Љ—Г—В–∞—Ж–Є–є –≤ –≥–µ–љ–µ –Р–†–† –≤—Б—В—А–µ—З–∞—О—В—Б—П –≤ 3вАУ5%
–≤—Б–µ—Е —Б–µ–Љ–µ–є —Б –њ—А–µ—Б–µ–љ–Є–ї—М–љ—Л–Љ —В–Є–њ–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Э–∞—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤ —Н—В–Є—Е —Б–µ–Љ—М—П—Е –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–Њ
–∞—Г—В–Њ—Б–Њ–Љ–љ–Њ-–і–Њ–Љ–Є–љ–∞–љ—В–љ–Њ–Љ—Г —В–Є–њ—Г. –Ь—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–µ PSN-1
–Њ–Ї–∞–Ј–∞–ї–Є—Б—М –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ 60вАУ70% –≤—Б–µ—Е —А–∞–љ–љ–Є—Е
(–њ—А–µ—Б–µ–љ–Є–ї—М–љ—Л—Е) —Б–ї—Г—З–∞–µ–≤ —Б–µ–Љ–µ–є–љ–Њ–є —Д–Њ—А–Љ—Л –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ (–Э.–Э.–†—П–Ј–∞–љ—Б–Ї–∞—П –Є —Б–Њ–∞–≤—В., 1999).
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Љ—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–µ PSN-2 –±–Њ–ї–µ–µ —А–µ–і–Ї–Є.
–Ю–љ–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є —В–Њ–ї—М–Ї–Њ –≤
–Є—В–∞–ї—М—П–љ—Б–Ї–Є—Е —Б–µ–Љ—М—П—Е –Є –≤ —Б–µ–Љ—М—П—Е –њ–Њ–≤–Њ–ї–ґ—Б–Ї–Є—Е –љ–µ–Љ—Ж–µ–≤.
–Ь—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–µ PSN-1 —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –њ–Њ–ї–љ–Њ–є
–њ–µ–љ–µ—В—А–∞–љ—В–љ–Њ—Б—В—М—О –Є –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –њ—А–Њ—П–≤–ї—П—О—В—Б—П –≤
–≤–Њ–Ј—А–∞—Б—В–µ –Њ—В 30 –і–Њ 50 –ї–µ—В. –Ь—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–µ PSN-2
—Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П –љ–µ–њ–Њ–ї–љ–Њ–є –њ–µ–љ–µ—В—А–∞–љ—В–љ–Њ—Б—В—М—О, –Њ–љ–Є
–≤–Њ–≤–ї–µ—З–µ–љ—Л –≤ —А–∞–Ј–≤–Є—В–Є–µ –±–Њ–ї–µ–µ —А–µ–і–Ї–Є—Е –Ї–∞–Ї —А–∞–љ–љ–Є—Е, —В–∞–Ї
–Є –њ–Њ–Ј–і–љ–Є—Е —Б–µ–Љ–µ–є–љ—Л—Е —Д–Њ—А–Љ –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞.
–†–Њ–ї—М –Љ—Г—В–∞—Ж–Є–є –Є–ї–Є –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–≤ –≤ –њ—А–µ—Б–µ–љ–Є–ї–Є–љ–∞—Е –≤
—А–∞–Ј–≤–Є—В–Є–Є —Б–њ–Њ—А–∞–і–Є—З–µ—Б–Ї–Є—Е —Б–ї—Г—З–∞–µ–≤ –њ–Њ–Ј–і–љ–µ–є –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ (—В.–µ. —Б–µ–љ–Є–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞) –њ–Њ–Ї–∞ –Њ—Б—В–∞–µ—В—Б—П
–љ–µ–≤—Л—П—Б–љ–µ–љ–љ–Њ–є.
–Я–∞—А–∞–Љ–µ—В—А—Л, –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–µ –≤
–і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ
–±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞
–Я—А–µ—Б–µ–љ–Є–ї—М–љ—Л–є
—В–Є–њ –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ (—Б–Є–љ–Њ–љ–Є–Љ:
–њ—А–µ—Б–µ–љ–Є–ї—М–љ–∞—П –і–µ–Љ–µ–љ—Ж–Є—П –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞) |
–°–µ–љ–Є–ї—М–љ—Л–є
—В–Є–њ –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ (—Б–Є–љ–Њ–љ–Є–Љ:
—Б–µ–љ–Є–ї—М–љ–∞—П
–і–µ–Љ–µ–љ—Ж–Є—П –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞) |
–Э–∞—З–∞–ї–Њ
–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –њ—А–µ—Б–µ–љ–Є–ї—М–љ–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ
–Ь–µ–і–ї–µ–љ–љ–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –±–Њ–ї–µ–Ј–љ–Є –љ–∞ –Є–љ–Є—Ж–Є–∞–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ
–Є –±—Л—Б—В—А–Њ–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –љ–∞ —Н—В–∞–њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є
–≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є
–Я–Њ—П–≤–ї–µ–љ–Є–µ –Ї–Њ—А–Ї–Њ–≤—Л—Е –і–Є—Б—Д—Г–љ–Ї—Ж–Є–є —Г–ґ–µ –љ–∞
—А–∞–љ–љ–Є—Е —Н—В–∞–њ–∞—Е –±–Њ–ї–µ–Ј–љ–Є
–Ь–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–µ —В—П–ґ–µ–ї–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –≤—Л—Б—И–Є—Е –Ї–Њ—А–Ї–Њ–≤—Л—Е
—Д—Г–љ–Ї—Ж–Є–є –љ–∞ —Н—В–∞–њ–µ —В—П–ґ–µ–ї–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є, –≤–њ–ї–Њ—В—М –і–Њ
"–љ–µ–≤—А–Њ–ї–Њ–≥–Є–Ј–∞—Ж–Є–Є" —А–∞—Б—Б—В—А–Њ–є—Б—В–≤
–Ф–ї–Є—В–µ–ї—М–љ–∞—П —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В—М —А–µ–∞–Ї—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞
–±–Њ–ї–µ–Ј–љ—М –Є –Њ—Б–љ–Њ–≤–љ—Л—Е –µ–≥–Њ –ї–Є—З–љ–Њ—Б—В–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є
–Ю—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –≥–Њ–Љ–Њ–≥–µ–љ–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞
–љ–∞ —А–∞–Ј–≤–µ—А–љ—Г—В–Њ–Љ —Н—В–∞–њ–µ –і–µ–Љ–µ–љ—Ж–Є–Є
(–∞—Д–∞—В–Њ-–∞–њ—А–∞–Ї—В–Њ-–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П –і–µ–Љ–µ–љ—Ж–Є—П) |
–Э–∞—З–∞–ї–Њ
–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ —Б—В–∞—А—З–µ—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ
–Ь–µ–љ–µ–µ –њ—А–Њ–≥—А–µ–і–Є–µ–љ—В–љ–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –±–Њ–ї–µ–Ј–љ–Є –љ–∞ –≤—Б–µ—Е
—Н—В–∞–њ–∞—Е
–µ–µ —В–µ—З–µ–љ–Є—П, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –Ї–Њ–љ–µ—З–љ–Њ–≥–Њ
–Э–∞—А—Г—И–µ–љ–Є–µ –≤—Л—Б—И–Є—Е –Ї–Њ—А–Ї–Њ–≤—Л—Е —Д—Г–љ–Ї—Ж–Є–є –љ–∞ —Н—В–∞–њ–µ
–і–∞–ї–µ–Ї–Њ
–Ј–∞—И–µ–і—И–µ–є –і–µ–Љ–µ–љ—Ж–Є–Є
–Ю–±—Й–µ–µ —Г—Е—Г–і—И–µ–љ–Є–µ –≤—Л—Б—И–Є—Е –Ї–Њ—А–Ї–Њ–≤—Л—Е —Д—Г–љ–Ї—Ж–Є–є,
–Ї–Њ—В–Њ—А–Њ–µ —А–µ–і–Ї–Њ –і–Њ—Б—В–Є–≥–∞–µ—В —Б—В–µ–њ–µ–љ–Є —П–≤–љ—Л—Е
–Њ—З–∞–≥–Њ–≤—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤
–Т—Л—А–∞–ґ–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –ї–Є—З–љ–Њ—Б—В–Є
–Є —Г—В—А–∞—В–∞ –Ї—А–Є—В–Є–Ї–Є –Ї –±–Њ–ї–µ–Ј–љ–Є —Г–ґ–µ –љ–∞ —А–∞–љ–љ–Є—Е –µ–µ
—Н—В–∞–њ–∞—Е
–У–µ—В–µ—А–Њ–≥–µ–љ–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П
–Ї–∞—А—В–Є–љ–∞ (—А–∞–Ј–ї–Є—З–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Д–Њ—А–Љ—Л) –і–µ–Љ–µ–љ—Ж–Є–Є
|
–§—Г–љ–Ї—Ж–Є–Є –≥–µ–љ–љ—Л—Е –Љ—Г—В–∞—Ж–Є–є –Є –Є—Е —А–Њ–ї—М –≤ –њ—Г—Б–Ї–Њ–≤—Л—Е
–Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е –±–Њ–ї–µ–Ј–љ–Є –µ—Й–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ —П—Б–љ—Л.
–Ю–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Љ—Г—В–∞—Ж–Є–Є –≤ –≥–µ–љ–µ
–±–µ–ї–Ї–∞-–њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–∞
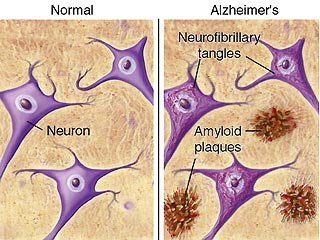
b-–∞–Љ–Є–ї–Њ–Є–і–∞ (b-–Р–†–†) –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ
–њ—А–Њ–і—Г–Ї—Ж–Є–Є b-–∞–Љ–Є–ї–Њ–Є–і–∞,
–Є–Ј –Ї–Њ—В–Њ—А–Њ–≥–Њ —Д–Њ—А–Љ–Є—А—Г—О—В—Б—П —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ
—Б–µ–љ–Є–ї—М–љ—Л–µ –Є–ї–Є –∞–Љ–Є–ї–Њ–Є–і–љ—Л–µ –±–ї—П—И–Ї–Є, –њ—А–µ–і—Б—В–∞–≤–ї—П—О—Й–Є–µ
—Б–Њ–±–Њ–є –Њ–і–Є–љ –Є–Ј –і–≤—Г—Е –≥–ї–∞–≤–љ—Л—Е –љ–µ–є—А–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е
—Д–µ–љ–Њ–Љ–µ–љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Я–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –Њ—В–ї–Њ–ґ–µ–љ–Є—П
b-–∞–Љ–Є–ї–Њ–Є–і–∞ –≤ –≤–Є–і–µ –∞–≥—А–µ–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е
—Б–Ї–Њ–њ–ї–µ–љ–Є–є (—Б–µ–љ–Є–ї—М–љ—Л—Е –±–ї—П—И–µ–Ї) –≤ —Н–Ї—Б—В—А–∞—Ж–µ–ї–ї—О–ї—П—А–љ—Л—Е
–њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞—Е –Ї–Њ—А—Л –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Њ–±–ї–∞–і–∞—О—В
–љ–µ–є—А–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В—М—О –Є –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ —А–∞–Ј–≤–Є—В–Є–µ
–і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –±–ї–Є–Ј–ї–µ–ґ–∞—Й–Є—Е
–љ–µ–є—А–Њ–љ–∞—Е.
–°–∞–Љ –њ–Њ —Б–µ–±–µ b-–∞–Љ–Є–ї–Њ–Є–і
–њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –њ—А–Њ–і—Г–Ї—В —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ
–њ—А–Њ—В–µ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Њ–≥–Њ —А–∞–Ј—А—Г—И–µ–љ–Є—П
–≤—Л—Б–Њ–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ b-–Р–†–†. –Ю–і–љ–∞–Ї–Њ –ї–Є—И—М –≤—Л–Ј–≤–∞–љ–љ–∞—П
–Љ—Г—В–∞—Ж–Є—П–Љ–Є –≤ –≥–µ–љ–µ b-–Р–†–† –≥–Є–њ–µ—А–њ—А–Њ–і—Г–Ї—Ж–Є—П b-–∞–Љ–Є–ї–Њ–Є–і–∞ –Є–ї–Є —Г–і–ї–Є–љ–µ–љ–Є–µ –µ–≥–Њ –Љ–Њ–ї–µ–Ї—Г–ї—Л
–Ј–∞ —Б—З–µ—В –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є—П –і–≤—Г—Е –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е
–∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –њ—А–Њ—Ж–µ—Б—Б—Г
—Г—Б–Є–ї–µ–љ–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е –±–ї—П—И–µ–Ї,
–њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Г–і–ї–Є–љ–µ–љ–љ—Л–µ –њ–µ–њ—В–Є–і—Л –∞–≥—А–µ–≥–Є—А—Г—О—В
–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ, —З–µ–Љ –±–Њ–ї–µ–µ –Ї–Њ—А–Њ—В–Ї–Є–µ –Є—Е —Д–Њ—А–Љ—Л.
–Ш–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є –љ–µ–і–∞–≤–љ–Њ e4-–Є–Ј–Њ–Љ–Њ—А—Д–љ—Л–є
–≤–∞—А–Є–∞–љ—В –≥–µ–љ–∞ –∞–њ–Њ–ї–Є–њ–Њ–њ—А–Њ—В–µ–Є–љ–∞ –Х (–Р—А–Њ–Х) –њ—А–Є–Ј–љ–∞–љ –≤
–љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≥–ї–∞–≤–љ—Л–Љ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ
—А–Є—Б–Ї–∞ –њ–Њ–і–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –њ–Њ–Ј–і–љ–µ–є –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞.
–Р—А–Њ–Х вАУ –±–µ–ї–Њ–Ї —Б –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є —Д—Г–љ–Ї—Ж–Є—П–Љ–Є, –Ї–Њ—В–Њ—А—Л–є
—Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ, –љ–Њ –љ–µ –≤
–љ–µ–є—А–Њ–љ–∞—Е, –∞ –≤ –≥–ї–Є–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е. –Р—А–Њ–Х —Г—З–∞—Б—В–≤—Г–µ—В –≤
–њ—А–Њ—Ж–µ—Б—Б–∞—Е —А–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є –њ—А–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П—Е
—Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Я–Њ–ї—Г—З–µ–љ—Л
–і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —Г—З–∞—Б—В–Є—П –Р—А–Њ–Х –≤ –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ–Љ
—Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–Љ —Б–Є–љ–∞–њ—В–Њ–≥–µ–љ–µ–Ј–µ (J.Porier –Є —Б–Њ–∞–≤—В., 1993).
–Я–Њ–Ї–∞–Ј–∞–љ–∞ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –≥–µ–љ–Њ—В–Є–њ–∞ –Р—А–Њ–Х –Є
—Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –њ—А–Є –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞: —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є
–∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ—В—А–∞–љ—Б—Д–µ—А–∞–Ј—Л –≤ –≥–Є–њ–њ–Њ–Ї–∞–Љ–њ–µ –Є –≤–Є—Б–Њ—З–љ–Њ–є
–Ї–Њ—А–µ –Њ–±—А–∞—В–љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–Њ —З–Є—Б–ї—Г –Ї–Њ–њ–Є–є –∞–ї–ї–µ–ї—П
e4 –≥–µ–љ–∞ –Р—А–Њ–Х (J.Porier –Є —Б–Њ–∞–≤—В., 1998).
–Э–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л,
–≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—Й–Є–µ —Б –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є –њ—А–µ—Б–µ–љ–Є–ї–Є–љ–Њ–≤,
–Р–†–† –Є–ї–Є –Р—А–Њ–Х, –µ—Й–µ –ґ–і—Г—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞ –∞–і–µ–Ї–≤–∞—В–љ—Л—Е
–Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–Њ–і–µ–ї—П—Е –Є–ї–Є –Љ–Њ–і–µ–ї—П—Е —В—А–∞–љ—Б–≥–µ–љ–љ—Л—Е
–ґ–Є–≤–Њ—В–љ—Л—Е. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, —З—В–Њ –≤—Б–µ
–Њ—В–Ї—А—Л—В—Л–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –∞–љ–Њ–Љ–∞–ї–Є–Є —В–∞–Ї –Є–ї–Є –Є–љ–∞—З–µ
–≤–ї–Є—П—О—В –љ–∞ –њ—А–Њ—Ж–µ—Б—Б—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –≤
–∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П—Е, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–≤–Њ–і—П—В
–Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О –љ–µ–є—А–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Є—Е
–∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е –±–ї—П—И–µ–Ї.
–Я—А–Є–Ј–љ–∞–љ–Є–µ –љ–∞–є–і–µ–љ–љ—Л—Е –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ—Г—В–∞—Ж–Є–є
—Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ —З–∞—Б—В–Є
—Б–ї—Г—З–∞–µ–≤ –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞, –Њ—Б–љ–Њ–≤–∞–љ–Њ –љ–∞
–њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–Є –Њ —В–Њ–Љ, —З—В–Њ –∞–љ–Њ–Љ–∞–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б
–∞–Љ–Є–ї–Њ–Є–і–Њ–≥–µ–љ–µ–Ј–∞ —П–≤–ї—П–µ—В—Б—П –Ї–ї—О—З–µ–≤—Л–Љ
–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –Ј–≤–µ–љ–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Т
—Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Н—В–Њ–є –≥–Є–њ–Њ—В–µ–Ј–Њ–є –∞–љ–Њ–Љ–∞–ї—М–љ—Л–є
–∞–Љ–Є–ї–Њ–Є–і–Њ–≥–µ–љ–µ–Ј –њ—А–µ–і—И–µ—Б—В–≤—Г–µ—В –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї—П—А–љ—Л–Љ
–Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ, –≤—Л—Б—В—Г–њ–∞—П –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є—З–Є–љ—Л
–љ–µ–є—А–Њ–љ–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –≥–Є–±–µ–ї–Є
–љ–µ–є—А–Њ–љ–Њ–≤.
–Ю–і–љ–∞–Ї–Њ –Љ–Њ—А—Д–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–µ –Є–Ј—Г—З–µ–љ–Є–µ –±–Є–Њ–њ—Б–Є–є–љ–Њ–≥–Њ
–Є –∞—Г—В–Њ–њ—Б–Є–є–љ–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —В—П–ґ–µ—Б—В—М
–і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞, –Њ—В—А–∞–ґ–∞—О—Й–∞—П
–њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤ –±–Њ–ї—М—И–µ–є –Љ–µ—А–µ
–Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В –љ–µ —Б –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ —Б–µ–љ–Є–ї—М–љ—Л—Е
(–∞–Љ–Є–ї–Њ–Є–і–љ—Л—Е) –±–ї—П—И–µ–Ї, –∞ —Б –њ–ї–Њ—В–љ–Њ—Б—В—М—О
–љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї—П—А–љ—Л—Е –Ї–ї—Г–±–Ї–Њ–≤ –Є —Г—В—А–∞—В–Њ–є —Б–Є–љ–∞–њ—Б–Њ–≤
(E.Masliah –Є —Б–Њ–∞–≤—В., 1994; E.Masliah, 1995).
–Я–Њ –Љ–љ–µ–љ–Є—О H.Braak –Є –Х.Braak (1996), –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ,
–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ,
–≤—Л–Ј—Л–≤–∞—О—Й–Є–Љ –≥–Є–±–µ–ї—М –љ–µ–є—А–Њ–љ–Њ–≤ –Є —А–∞–Ј–≤–Є—В–Є–µ –і–µ–Љ–µ–љ—Ж–Є–Є,
—П–≤–ї—П–µ—В—Б—П –љ–µ –∞–љ–Њ–Љ–∞–ї—М–љ—Л–є –∞–Љ–Є–ї–Њ–Є–і–Њ–≥–µ–љ–µ–Ј, –∞
–љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –≥–Є–њ–µ—А—Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ
–љ–µ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–≥–Њ —В–∞—Г-–њ—А–Њ—В–µ–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В
–Њ—Б–љ–Њ–≤—Г –њ–∞—А–љ–Њ—Б–Ї—А—Г—З–µ–љ–љ—Л—Е —Д–Є–ї–∞–Љ–µ–љ—В, –Њ–±—А–∞–Ј—Г—О—Й–Є—Е
–љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї—П—А–љ—Л–µ –Ї–ї—Г–±–Ї–Є. –Ф–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–Њ–Љ
—Б–њ—А–∞–≤–µ–і–ї–Є–≤–Њ—Б—В–Є —Н—В–Њ–є –≥–Є–њ–Њ—В–µ–Ј—Л —Б–ї—Г–ґ–∞—В –і–∞–љ–љ—Л–µ –Њ–±
–Є–µ—А–∞—А—Е–Є—З–µ—Б–Ї–Њ–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–Є
–љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї—П—А–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є
–њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л–Љ –њ–µ—А–µ—Е–Њ–і–∞–Љ –≤ —А–∞–Ј–≤–Є—В–Є–Є –±–Њ–ї–µ–Ј–љ–Є
–Њ—В –Є–љ–Є—Ж–Є–∞–ї—М–љ—Л—Е –і–Њ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ї –Љ—П–≥–Ї–Њ–є
–Є –і–∞–ї–µ–µ –Ї —Г–Љ–µ—А–µ–љ–љ–Њ–є –Є —В—П–ґ–µ–ї–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є (H.Braak, E.Braak,
1991, 1996; L.Berg –Є —Б–Њ–∞–≤—В., 1993).
–Ф—А—Г–≥–Є–Љ –љ–µ–є—А–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Д–µ–љ–Њ–Љ–µ–љ–Њ–Љ,
–Ї–Њ—В–Њ—А—Л–є –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В –њ–∞—А–∞–ї–ї–µ–ї–Є–Ј–Љ —Б
–њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ–≥–љ–Є—В–Є–≤–љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П,
—П–≤–ї—П–µ—В—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–Є—Б–ї–∞ —Б–Є–љ–∞–њ—Б–Њ–≤ –≤ –ї–Њ–±–љ–Њ–є –Є
–≤–Є—Б–Њ—З–љ–Њ–є –Ї–Њ—А–µ –Є –≤ –≥–Є–њ–њ–Њ–Ї–∞–Љ–њ–µ (R.Terry, 1994). –С—Л–ї–Њ
–Є–Ј—Г—З–µ–љ–Њ, –Ї–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ —Г—В—А–∞—В–∞ —Б–Є–љ–∞–њ—Б–Њ–≤ –≤
—А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–Њ—А—Д–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А–∞—Е –Љ–Њ–Ј–≥–∞
–Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є
–Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —В–∞–Ї–Њ–≥–Њ
–∞–љ–∞–ї–Є–Ј–∞ –≤—Л—Б–Ї–∞–Ј–∞–љ–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ, —З—В–Њ —А–∞–Ј–≤–Є—В–Є–µ
–і–µ–Љ–µ–љ—Ж–Є–Є –њ—А–Є –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –њ—А—П–Љ–Њ —Б–≤—П–Ј–∞–љ–Њ —Б
—Г—В—А–∞—В–Њ–є —Б–Є–љ–∞–њ—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–љ—В–∞–Ї—В–Њ–≤ –≤ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е
–Ї–Њ—А–Ї–Њ–≤—Л—Е –Є –њ–Њ–і–Ї–Њ—А–Ї–Њ–≤—Л—Е –Њ–±–ї–∞—Б—В—П—Е –Љ–Њ–Ј–≥–∞
(E.Masliah, R.Terry, 1993).
–Т—Л–њ–Њ–ї–љ–µ–љ–љ—Л–µ –Ї –љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ
–љ–µ–є—А–Њ–≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є –љ–µ–є—А–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ
–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –∞—Г—В–Њ–њ—Б–Є–є–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –±–Њ–ї—М–љ—Л—Е —Б
–і–µ–Љ–µ–љ—Ж–Є–µ–є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є
—Г—Б—В–∞–љ–Њ–≤–Є—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Ї–∞—Б–Ї–∞–і–Њ–≤ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е
—Б–Њ–±—Л—В–Є–є, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є—Е –љ–∞ –Ї–ї–µ—В–Њ—З–љ–Њ–Љ —Г—А–Њ–≤–љ–µ,
–Ї–Њ—В–Њ—А—Л–µ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ –≤–Њ–≤–ї–µ—З–µ–љ—Л –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј
–Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П: –љ–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤
—Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –±–µ–ї–Ї–Њ–≤, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤
–Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –≥–ї—О–Ї–Њ–Ј—Л –Є –∞–Ї—В–Є–≤–∞—Ж–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤
–њ–µ—А–µ–Ї–Є—Б–љ–Њ–≥–Њ –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ї–Є–њ–Є–і–Њ–≤. –Т—Л—Б–Ї–∞–Ј–∞–љ–Њ
–њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ, —З—В–Њ –Ї–∞–ґ–і—Л–є –Є–Ј
—В–∞–Ї–Є—Е –Ї–∞—Б–Ї–∞–і–Њ–≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є –Є–ї–Є –Є—Е
—Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В—М –Љ–Њ–≥—Г—В –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –њ—А–Є–≤–Њ–і–Є—В—М –Ї
–Њ–њ–Є—Б–∞–љ–љ—Л–Љ –≤—Л—И–µ —Б—В—А—Г–Ї—В—Г—А–љ—Л–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ, –Ї–Њ—В–Њ—А—Л–µ
–ї–µ–ґ–∞—В –≤ –Њ—Б–љ–Њ–≤–µ –љ–µ–є—А–Њ–љ–∞–ї—М–љ–Њ–є –і–µ–≥–µ–љ–µ—А–∞—Ж–Є–Є –Є
—Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ –і–µ–Љ–µ–љ—Ж–Є–Є.
–Я—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–є –Ї–∞—Г–Ј–∞–ї—М–љ–Њ–є —А–Њ–ї–Є
—Б–∞–Љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —Б—В–∞—А–µ–љ–Є—П –≤ —А–∞–Ј–≤–Є—В–Є–Є –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ
–љ–µ–є—А–Њ–і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –њ—А–Є–≤–Њ–і—П—Й–µ–≥–Њ –Ї
–љ–µ–є—А–Њ–љ–∞–ї—М–љ–Њ–є –≥–Є–±–µ–ї–Є, –∞ –љ–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ —Г—А–Њ–≤–љ–µ вАУ –Ї
—А–∞–Ј–≤–Є—В–Є—О –і–µ–Љ–µ–љ—Ж–Є–Є, —Е–Њ—А–Њ—И–Њ —Б–Њ–≥–ї–∞—Б—Г–µ—В—Б—П —Б
—Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ–Є –≤ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е
–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –і–∞–љ–љ—Л–Љ–Є –Њ–± —Н–Ї—Б–њ–Њ–љ–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є
–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є —З–∞—Б—В–Њ—В—Л —Б–µ–љ–Є–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞. –Я–Њ–Љ–Є–Љ–Њ
—Б–≤—П–Ј–∞–љ–љ—Л—Е —Б–Њ —Б—В–∞—А–µ–љ–Є–µ–Љ –љ–∞—А—Г—И–µ–љ–Є–є —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–≥–Њ
–Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≥–ї—О–Ї–Њ–Ј—Л, –љ–∞ —Д–Њ–љ–µ —Б—В–∞—А–µ–љ–Є—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В
—Г—Б–Є–ї–µ–љ–Є–µ —Б–≤–Њ–±–Њ–і–љ–Њ—А–∞–і–Є–Ї–∞–ї—М–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, —З—В–Њ
–≤–љ–Њ—Б–Є—В —Б–≤–Њ–є –≤–Ї–ї–∞–і –≤ —Ж–µ–њ–Њ—З–Ї—Г –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е
—Б–Њ–±—Л—В–Є–є, —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П –љ–µ–є—А–Њ–љ–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є
–њ—А–Є –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞.
–Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є —Б—В–∞—А–µ–љ–Є–Є –Њ—Б–ї–∞–±–ї—П–µ—В—Б—П
–Ї–Њ–љ—В—А–Њ–ї—М –љ–∞–і —Б–≤–Њ–±–Њ–і–љ–Њ—А–∞–і–Є–Ї–∞–ї—М–љ—Л–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є, –≤
—З–∞—Б—В–љ–Њ—Б—В–Є –Є–Ј-–Ј–∞ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є a-—В–Њ–Ї–Њ—Д–µ—А–Њ–ї–∞ –Є–ї–Є
—Н–Ї–Ј–Њ–≥–µ–љ–љ–Њ–≥–Њ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –њ—А–Є—А–Њ–і–љ—Л—Е
–∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л—Е —Б–Є—Б—В–µ–Љ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ. –†–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ
—Н—В–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —П–≤–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–∞—Ж–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤
–њ–µ—А–µ–Ї–Є—Б–љ–Њ–≥–Њ –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ї–Є–њ–Є–і–Њ–≤, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В
–љ–∞–Ї–Њ–њ–ї–µ–љ–Є—О –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —Б–≤–Њ–±–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤ вАУ
–Љ–Њ–ї–µ–Ї—Г–ї, –Ї–Њ—В–Њ—А—Л–µ –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –Љ–Њ–≥—Г—В –≤—Л–Ј—Л–≤–∞—В—М
–љ–µ–Њ–±—А–∞—В–Є–Љ—Л–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Ї–∞–Ї –љ–∞ —Г—А–Њ–≤–љ–µ –Ї–ї–µ—В–Ї–Є,
—В–∞–Ї –Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤ —Ж–µ–ї–Њ–Љ. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –∞–Ї—В–Є–≤–∞—Ж–Є—П
–њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ–µ—А–µ–Ї–Є—Б–љ–Њ–≥–Њ –Њ–Ї–Є—Б–ї–µ–љ–Є—П –ї–Є–њ–Є–і–Њ–≤
–њ—А–Є–≤–Њ–і–Є—В –Ї –Є–Ј–Љ–µ–љ–µ–љ–Є—О —Б—В—А—Г–Ї—В—Г—А–љ–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є
–Љ–µ–Љ–±—А–∞–љ (—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ–Њ–≥–Њ —Б–Њ—Б—В–∞–≤–∞, –Љ–Є–Ї—А–Њ–≤—П–Ј–Ї–Њ—Б—В–Є –Є
–є–Њ–љ–љ–Њ–є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є), –љ–∞—А—Г—И–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–є
–Љ–µ–Љ–±—А–∞–љ–Њ—Б–≤—П–Ј–∞–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤ –Є —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤,
–њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—О –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ—Л—Е –±–µ–ї–Ї–Њ–≤ –Є
–≤—Б–ї–µ–і—Б—В–≤–Є–µ —Н—В–Њ–≥–Њ вАУ –Ї –Ї–ї–µ—В–Њ—З–љ–Њ–Љ—Г —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–Љ—Г
–і–µ—Д–Є—Ж–Є—В—Г.
–Я—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ —Б—В–∞—А–µ–љ–Є–Є –≤—Б–µ —Н—В–Є –њ–∞—А–∞–Љ–µ—В—А—Л –љ–µ
—А–µ–Ј–Ї–Њ —Г—Е—Г–і—И–∞—О—В—Б—П –њ–Њ –Љ–µ—А–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –≤–Њ–Ј—А–∞—Б—В–∞, –љ–Њ
–≤ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Г—Б–ї–Њ–≤–Є—П—Е, –љ–∞–њ—А–Є–Љ–µ—А –њ—А–Є —Б—В—А–µ—Б—Б–µ
–Є–ї–Є —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є –Є—И–µ–Љ–Є–Є, —В–µ–Љ–њ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–≥–Њ
—Б–љ–Є–ґ–µ–љ–Є—П –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≥–ї—О–Ї–Њ–Ј—Л –Є
–љ–∞—А—Г—И–µ–љ–Є—П —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –≤ –Љ–Њ–Ј–≥–µ —А–µ–Ј–Ї–Њ
—Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П.
–Т —Н—В–Њ–Љ —Б–Љ—Л—Б–ї–µ —Б–∞–Љ–Њ –њ–Њ —Б–µ–±–µ —Б—В–∞—А–µ–љ–Є–µ –Љ–Њ–ґ–µ—В
–≤—Л—Б—В—Г–њ–∞—В—М –љ–µ —В–Њ–ї—М–Ї–Њ –≤ —А–Њ–ї–Є —Д–∞–Ї—В–Њ—А–∞ —А–Є—Б–Ї–∞, –∞,
–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –і–∞–ґ–µ –Є –≤ —А–Њ–ї–Є
–µ–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Н—В–Є–Њ–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞
–≤ —А–∞–Ј–≤–Є—В–Є–Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–Њ–Ј–і–љ–Є—Е —Д–Њ—А–Љ –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞, —В.–µ. —Б–µ–љ–Є–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –Є
–Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П
–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б
–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є,
—А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–Љ–Є –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–Љ–Є —Н–Ї—Б–њ–µ—А—В–љ—Л–Љ–Є
–≥—А—Г–њ–њ–∞–Љ–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ NINCDS-ADRDA (G.D.McKhan –Є —Б–Њ–∞–≤—В., 1984),
DSM-IV (APA, 1994), CERAD (M.Gearing –Є —Б–Њ–∞–≤—В., 1995), –Є —Г—В–≤–µ—А–ґ–і–µ–љ–љ–Њ–є
–Т–Ю–Ч –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–µ–є –±–Њ–ї–µ–Ј–љ–Є 10-–≥–Њ
–њ–µ—А–µ—Б–Љ–Њ—В—А–∞ –њ—А–Є–ґ–Є–Ј–љ–µ–љ–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Њ—Б–љ–Њ–≤–∞–љ –љ–∞ –њ—А–Є—Б—Г—В—Б—В–≤–Є–Є —Б–ї–µ–і—Г—О—Й–Є—Е
–Њ–±–ї–Є–≥–∞—В–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤:
1. –Э–∞–ї–Є—З–Є–µ —Б–Є–љ–і—А–Њ–Љ–∞ –і–µ–Љ–µ–љ—Ж–Є–Є.
2. –†–∞–Ј–≤–Є—В–Є–µ –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞
–њ–Њ–Ј–љ–∞–≤–∞—В–µ–ї—М–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є, –Ї–Њ—В–Њ—А—Л–є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П
—Б–Њ—З–µ—В–∞–љ–Є–µ–Љ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –њ–∞–Љ—П—В–Є —Б —Г—Е—Г–і—И–µ–љ–Є–µ–Љ
–Ј–∞–њ–Њ–Љ–Є–љ–∞–љ–Є—П –љ–Њ–≤–Њ–є –Є/–Є–ї–Є –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Є—П —А–∞–љ–µ–µ
—Г—Б–≤–Њ–µ–љ–љ–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Є –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤
–њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ –Њ–і–љ–Њ–≥–Њ –Є–Ј —Б–ї–µ–і—Г—О—Й–Є—Е –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е
–љ–∞—А—Г—И–µ–љ–Є–є:
–∞—Д–∞–Ј–Є–Є (–љ–∞—А—Г—И–µ–љ–Є–µ —А–µ—З–µ–≤–Њ–є —Д—Г–љ–Ї—Ж–Є–Є),
–∞–њ—А–∞–Ї—Б–Є–Є (–љ–∞—А—Г—И–µ–љ–Є–µ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї –≤—Л–њ–Њ–ї–љ–µ–љ–Є—О
–і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞
–љ–µ–љ–∞—А—Г—И–µ–љ–љ—Л–µ –Љ–Њ—В–Њ—А–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є);
–∞–≥–љ–Њ–Ј–Є–Є (–љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —А–∞—Б–њ–Њ–Ј–љ–∞–≤–∞—В—М –Є–ї–Є
–Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М –Њ–±—К–µ–Ї—В—Л, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б–Њ—Е—А–∞–љ–љ–Њ–µ
—Б–µ–љ—Б–Њ—А–љ–Њ–µ –≤–Њ—Б–њ—А–Є—П—В–Є–µ);
–љ–∞—А—Г—И–µ–љ–Є–є —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –Є–љ—В–µ–ї–ї–µ–Ї—В—Г–∞–ї—М–љ–Њ–є
–і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є, —В.–µ. –њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–Є—П –Є
–њ—А–Њ–≥—А–∞–Љ–Љ–Є—А–Њ–≤–∞–љ–Є—П –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є, –∞–±—Б—В—А–∞–≥–Є—А–Њ–≤–∞–љ–Є—П,
—Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –њ—А–Є—З–Є–љ–љ–Њ-—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л—Е —Б–≤—П–Ј–µ–є –Є –і—А.
3. –Э–∞—А—Г—И–µ–љ–Є—П –Ї–∞–Ї –њ–∞–Љ—П—В–Є, —В–∞–Ї –Є –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е
—Д—Г–љ–Ї—Ж–Є–є –і–Њ–ї–ґ–љ—Л –±—Л—В—М –≤—Л—А–∞–ґ–µ–љ—Л –љ–∞—Б—В–Њ–ї—М–Ї–Њ, —З—В–Њ–±—Л
–≤—Л–Ј—Л–≤–∞—В—М —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –Є–ї–Є
–њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–і–∞–њ—В–∞—Ж–Є–Є –±–Њ–ї—М–љ–Њ–≥–Њ –њ–Њ
—Б—А–∞–≤–љ–µ–љ–Є—О —Б –µ–µ –њ—А–µ–ґ–љ–Є–Љ —Г—А–Њ–≤–љ–µ–Љ.
4. –Ґ–µ—З–µ–љ–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –њ–Њ—Б—В–µ–њ–µ–љ–љ—Л–Љ
–Љ–∞–ї–Њ–Ј–∞–Љ–µ—В–љ—Л–Љ –љ–∞—З–∞–ї–Њ–Љ –Є –љ–µ—Г–Ї–ї–Њ–љ–љ—Л–Љ
–њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –љ–∞—А—Г—И–µ–љ–Є–є –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е
—Д—Г–љ–Ї—Ж–Є–є.
5. –Ю—В—Б—Г—В—Б—В–≤—Г—О—В –і–∞–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–ї–Є
—Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –њ–∞—А–∞–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є,
–Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥–ї–Є –±—Л —Г–Ї–∞–Ј–∞—В—М –љ–∞ —В–Њ, —З—В–Њ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞
–њ–∞–Љ—П—В–Є –Є –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л
–Ї–∞–Ї–Є–Љ-–ї–Є–±–Њ –і—А—Г–≥–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ –Є–ї–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ–Љ
—Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л (–љ–∞–њ—А–Є–Љ–µ—А,
—Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, –±–Њ–ї–µ–Ј–љ—М—О
–Я–∞—А–Ї–Є–љ—Б–Њ–љ–∞ –Є–ї–Є –Я–Є–Ї–∞, —Е–Њ—А–µ–µ–є –У–µ–љ—В–Є–љ–≥—В–Њ–љ–∞,
—Б—Г–±–і—Г—А–∞–ї—М–љ–Њ–є –≥–µ–Љ–∞—В–Њ–Љ–Њ–є, –≥–Є–і—А–Њ—Ж–µ—Д–∞–ї–Є–µ–є –Є –і—А.),
—Б–Є—Б—В–µ–Љ–љ—Л–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, –Њ –Ї–Њ—В–Њ—А–Њ–Љ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ
–Њ–љ–Њ –Љ–Њ–ґ–µ—В –≤—Л–Ј—Л–≤–∞—В—М —Б–Є–љ–і—А–Њ–Љ –і–µ–Љ–µ–љ—Ж–Є–Є (–љ–∞–њ—А–Є–Љ–µ—А,
–≥–Є–њ–Њ—В–Є—А–µ–Њ–Є–і–Є–Ј–Љ, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –≤–Є—В–∞–Љ–Є–љ–∞ –Т12 –Є–ї–Є
—Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –≥–Є–њ–µ—А–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П, –љ–µ–є—А–Њ—Б–Є—Д–Є–ї–Є—Б,
–Т–Ш–І-–Є–љ—Д–µ–Ї—Ж–Є—П, —В—П–ґ–µ–ї–∞—П –Њ—А–≥–∞–љ–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Є
–і—А.) –Є–ї–Є —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є–Є (–≤ —В–Њ–Љ —З–Є—Б–ї–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є).
6. –Я—А–Є–Ј–љ–∞–Ї–Є –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е
–љ–∞—А—Г—И–µ–љ–Є–є –і–Њ–ї–ґ–љ—Л –≤—Л—П–≤–ї—П—В—М—Б—П –≤–љ–µ —Б–Њ—Б—В–Њ—П–љ–Є–є
–њ–Њ–Љ—А–∞—З–µ–љ–Є—П —Б–Њ–Ј–љ–∞–љ–Є—П.
7. –Р–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є–µ —Б–≤–µ–і–µ–љ–Є—П –Є –і–∞–љ–љ—Л–µ
–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є—Б–Ї–ї—О—З–∞—О—В —Б–≤—П–Ј—М
–≤—Л—П–≤–ї—П–µ–Љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є —Б
–Ї–∞–Ї–Є–Љ-–ї–Є–±–Њ –і—А—Г–≥–Є–Љ –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ
(–љ–∞–њ—А–Є–Љ–µ—А, —Б –і–µ–њ—А–µ—Б—Б–Є–µ–є, —И–Є–Ј–Њ—Д—А–µ–љ–Є–µ–є, —Г–Љ—Б—В–≤–µ–љ–љ–Њ–є
–Њ—В—Б—В–∞–ї–Њ—Б—В—М—О –Є –і—А.).
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е
–Ї—А–Є—В–µ—А–Є–µ–≤ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –њ–Њ–≤—Л—Б–Є—В—М —В–Њ—З–љ–Њ—Б—В—М
–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –і–Њ
90вАУ95% (K.A.Jellinger, C.Bancher,1994), –Њ–і–љ–∞–Ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ
–њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ –і–Є–∞–≥–љ–Њ–Ј–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ —В–Њ–ї—М–Ї–Њ —Б
–њ–Њ–Љ–Њ—Й—М—О –і–∞–љ–љ—Л—Е –љ–µ–є—А–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ, –Ї–∞–Ї
–њ—А–∞–≤–Є–ї–Њ, –њ–Њ—Б–Љ–µ—А—В–љ–Њ–≥–Њ, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ
–Љ–Њ–Ј–≥–∞.
–Э–µ–є—А–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—П –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞, –Ї
–љ–∞—Б—В–Њ—П—Й–µ–Љ—Г –≤—А–µ–Љ–µ–љ–Є –і–µ—В–∞–ї—М–љ–Њ –Є–Ј—Г—З–µ–љ–љ–∞—П,
—Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —А—П–і–Њ–Љ —В–Є–њ–Є—З–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, –Ї
—З–Є—Б–ї—Г –Ї–Њ—В–Њ—А—Л—Е –Њ—В–љ–Њ—Б—П—В—Б—П —Б–ї–µ–і—Г—О—Й–Є–µ: –∞—В—А–Њ—Д–Є—П
–≤–µ—Й–µ—Б—В–≤–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, —Г—В—А–∞—В–∞ –љ–µ–є—А–Њ–љ–Њ–≤ –Є
—Б–Є–љ–∞–њ—Б–Њ–≤, –≥—А–∞–љ—Г–ї–Њ–≤–∞–Ї—Г–Њ–ї—П—А–љ–∞—П –і–µ–≥–µ–љ–µ—А–∞—Ж–Є—П, –≥–ї–Є–Њ–Ј,
—Б–µ–љ–Є–ї—М–љ—Л–µ (–љ–µ–є—А–Є—В–Є—З–µ—Б–Ї–Є–µ) –±–ї—П—И–Ї–Є –Є
–љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї—П—А–љ—Л–µ –Ї–ї—Г–±–Ї–Є, –∞ —В–∞–Ї–ґ–µ –∞–Љ–Є–ї–Њ–Є–і–љ–∞—П
–∞–љ–≥–Є–Њ–њ–∞—В–Є—П. –Ю–і–љ–∞–Ї–Њ —В–Њ–ї—М–Ї–Њ –і–≤–∞ –Є–Ј –љ–Є—Е вАУ —Б–µ–љ–Є–ї—М–љ—Л–µ
–±–ї—П—И–Ї–Є –Є –љ–µ–є—А–Њ—Д–Є–±—А–Є–ї–ї—П—А–љ—Л–µ –Ї–ї—Г–±–Ї–Є вАУ
—А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ї–∞–Ї –Ї–ї—О—З–µ–≤—Л–µ
–љ–µ–є—А–Њ–Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Д–µ–љ–Њ–Љ–µ–љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є
–Є–Љ–µ—О—В –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ.
–°–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞
–Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–Љ –њ—А–Є–љ—Ж–Є–њ–µ. –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є
—Б –Ь–Ъ–С 10 (1992) –≤—Л–і–µ–ї—П—О—В—Б—П –і–≤–µ –µ–µ —Д–Њ—А–Љ—Л:
1) –±–Њ–ї–µ–Ј–љ—М –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ —Б —А–∞–љ–љ–Є–Љ, —В.–µ. –і–Њ 65 –ї–µ—В,
–љ–∞—З–∞–ї–Њ–Љ (—Б–Є–љ–Њ–љ–Є–Љ—Л: —В–Є–њ 2 –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞,
–њ—А–µ—Б–µ–љ–Є–ї—М–љ–∞—П –і–µ–Љ–µ–љ—Ж–Є—П –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞).
–≠—В–∞ —Д–Њ—А–Љ–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Є –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ –Є–љ–Њ–≥–і–∞ –Њ–±–Њ–Ј–љ–∞—З–∞–µ—В—Б—П
–Ї–∞–Ї "—З–Є—Б—В–∞—П" (pure) –±–Њ–ї–µ–Ј–љ—М –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞;
2) –±–Њ–ї–µ–Ј–љ—М –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ —Б –њ–Њ–Ј–і–љ–Є–Љ, —В.–µ. –њ–Њ—Б–ї–µ 65
–ї–µ—В, –љ–∞—З–∞–ї–Њ–Љ (—Б–Є–љ–Њ–љ–Є–Љ—Л: —В–Є–њ 1 –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞,
—Б–µ–љ–Є–ї—М–љ–∞—П –і–µ–Љ–µ–љ—Ж–Є—П –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞).
–Я—А–µ–і—Г—Б–Љ–Њ—В—А–µ–љ–Њ, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤—Л–і–µ–ї–µ–љ–Є–µ –∞—В–Є–њ–Є—З–љ–Њ–є
–±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Є–ї–Є –і–µ–Љ–µ–љ—Ж–Є–Є —Б–Љ–µ—И–∞–љ–љ–Њ–≥–Њ
—В–Є–њ–∞, —В.–µ. —Б–Њ—З–µ—В–∞–љ–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є–є, —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П
–±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є.
–Я–Њ —Б—Г—Й–µ—Б—В–≤—Г —В–Њ—В –ґ–µ —Е—А–Њ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Є–љ—Ж–Є–њ
–Ј–∞–ї–Њ–ґ–µ–љ –Є –≤ —И–Є—А–Њ–Ї–Њ –њ—А–Є–љ—П—В–Њ–Љ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ј–∞
—А—Г–±–µ–ґ–Њ–Љ –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–Љ –Є
—Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–Љ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–µ 4-–≥–Њ –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ вАУ DSM IV
(–Р–†–Р,1994), –≥–і–µ —А—Г–±—А–Є–Ї–∞ "–±–Њ–ї–µ–Ј–љ—М –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞"
–Є–Љ–µ–љ—Г–µ—В—Б—П –і–µ–Љ–µ–љ—Ж–Є–µ–є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞.
–Я—А–Є–≤–µ–і–µ–љ–љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Њ–љ–љ–∞—П —Б—Е–µ–Љ–∞,
–Њ—Б–љ–Њ–≤–∞–љ–љ–∞—П –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –љ–∞ —Д–Њ—А–Љ–∞–ї—М–љ–Њ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–Љ –Є
–Њ—В—З–∞—Б—В–Є —Д–µ–љ–Њ–Љ–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Ї—А–Є—В–µ—А–Є–Є,
–љ–µ—Б–Њ–Љ–љ–µ–љ–љ–Њ, –Њ—В–ї–Є—З–∞–µ—В—Б—П –њ—А–Њ—Б—В–Њ—В–Њ–є –Є —Г–і–Њ–±—Б—В–≤–Њ–Љ –і–ї—П
–Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ. –Ю–і–љ–∞–Ї–Њ
–Њ–љ–∞ –≤—А—П–і –ї–Є –Љ–Њ–ґ–µ—В —Б—З–Є—В–∞—В—М—Б—П —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–є —Б
—В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П —Н—В–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Є (–Є–ї–Є)
–њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞.
–Т —Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –±–Њ–ї–µ–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є
–њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П —И–≤–µ–і—Б–Ї–Є—Е
–Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є (C.G.Gottfries, 1993), –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞—О—Й–∞—П
–≤—Л–і–µ–ї–µ–љ–Є–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–Њ—А–Љ
–±–Њ–ї–µ–Ј–љ–Є: —Б–µ–Љ–µ–є–љ–Њ–є, —В.–µ.
–љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ-–Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є —Д–Њ—А–Љ—Л –њ—А–µ—Б–µ–љ–Є–ї—М–љ–Њ–є
–±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞; —Б–µ–љ–Є–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞; –∞—В–Є–њ–Є—З–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ —Б –њ—А–µ–Њ–±–ї–∞–і–∞—О—Й–µ–є –ї–Њ–±–љ–Њ-–і–Њ–ї–µ–≤–Њ–є
–і–µ–≥–µ–љ–µ—А–∞—Ж–Є–µ–є –Є –і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞
—Г –±–Њ–ї—М–љ—Л—Е —Б —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Ф–∞—Г–љ–∞. –Т—Л–і–µ–ї–µ–љ–Є–µ –і–≤—Г—Е
–љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е —В–Є–њ–Њ–≤, —В.–µ.
–њ—А–µ—Б–µ–љ–Є–ї—М–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Є —Б–µ–љ–Є–ї—М–љ–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞, –≤ —Н—В–Њ–є
–Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Њ—Б–љ–Њ–≤–∞–љ–Њ –љ–µ —В–Њ–ї—М–Ї–Њ –љ–∞ —А–∞–Ј–ї–Є—З–Є—П—Е –≤
–≤–Њ–Ј—А–∞—Б—В–µ –љ–∞—З–∞–ї–∞ –±–Њ–ї–µ–Ј–љ–Є, –љ–Њ –Є –љ–∞ —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П
–Ї–∞–ґ–і–Њ–є –Є–Ј —Г–Ї–∞–Ј–∞–љ–љ—Л—Е —Д–Њ—А–Љ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П—Е
–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ—Л –Є —В–µ—З–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –љ–∞
–љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ–є –њ—Б–Є—Е–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ
—Б–Є–љ–і—А–Њ–Љ–∞ –і–µ–Љ–µ–љ—Ж–Є–Є. –Ю–њ–Є—Б—Л–≤–∞–µ–Љ—Л–µ —И–≤–µ–і—Б–Ї–Є–Љ–Є
–∞–≤—В–Њ—А–∞–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г —Н—В–Є–Љ–Є
—Д–Њ—А–Љ–∞–Љ–Є —Б–Њ–≤–њ–∞–і–∞—О—В —Б —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ—Л–Љ –≤
–Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –≥–µ—А–Њ–љ—В–Њ–њ—Б–Є—Е–Є–∞—В—А–Є–Є
–і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Л–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –і–ї—П —А–∞–Ј–≥—А–∞–љ–Є—З–µ–љ–Є—П
—Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞, —В.–µ.
–њ—А–µ—Б–µ–љ–Є–ї—М–љ–Њ–≥–Њ —В–Є–њ–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Є —Б–µ–љ–Є–ї—М–љ–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ (–≠.–ѓ.–®—В–µ—А–љ–±–µ—А–≥,
1977; –°.–Ш.–У–∞–≤—А–Є–ї–Њ–≤–∞ –Є —Б–Њ–∞–≤—В., 1992), –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–≤–Њ–і—П—В—Б—П
–≤ —В–∞–±–ї–Є—Ж–µ.
–І—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –≤–∞–ґ–љ–Њ –Ї–∞–Ї –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ,
—В–∞–Ї –Є –і–ї—П –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Є—Е —Ж–µ–ї–µ–є –∞–і–µ–Ї–≤–∞—В–љ–Њ –Є
–µ–і–Є–љ–Њ–Њ–±—А–∞–Ј–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –≤
–Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Б—В–∞–і–Є–Є –µ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П, —З—В–Њ –≤ —Б–ї—Г—З–∞–µ
–і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ —А–∞–≤–љ–Њ—Ж–µ–љ–љ–Њ –њ–Њ
—Б—Г—Й–µ—Б—В–≤—Г —В—П–ґ–µ—Б—В–Є –і–µ–Љ–µ–љ—Ж–Є–Є. –Э–∞–Є–±–Њ–ї–µ–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –≤
—Н—В–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –љ–∞–Љ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П —И–Ї–∞–ї–∞,
—А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–∞—П –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є
(–°.–†.Hughes –Є —Б–Њ–∞–≤—В., 1982) вАУ Clinical Dementia Rating (CDR), –њ–Њ–Ј–і–љ–µ–µ
—Г—Б–Њ–≤–µ—А—И–µ–љ—Б—В–≤–Њ–≤–∞–љ–љ–∞—П L.Berg (1984, 1988). –Т —Н—В–Њ–є —И–Ї–∞–ї–µ
–њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –≤—Л–і–µ–ї–µ–љ–Є–µ —З–µ—В—Л—А–µ—Е
–њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е —Б—В–∞–і–Є–є —А–∞–Ј–≤–Є—В–Є—П –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ вАУ –Њ—В —Б—В–∞–і–Є–Є —Б–Њ–Љ–љ–Є—В–µ–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є
(CDR-0,5) —З–µ—А–µ–Ј —Б—В–∞–і–Є—О –Љ—П–≥–Ї–Њ–є (CDR-1) –Є —Г–Љ–µ—А–µ–љ–љ–Њ–є (CDR-2) –і–Њ
—В—П–ґ–µ–ї–Њ–є (CDR-3) –і–µ–Љ–µ–љ—Ж–Є–Є. –Я—А–Є —Н—В–Њ–Љ –љ—Г–ї–µ–≤–∞—П –Њ—Ж–µ–љ–Ї–∞
—Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Њ—В—Б—Г—В—Б—В–≤–Є—О –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є
–Є–ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —Г—А–Њ–≤–љ–µ —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –Є
–њ—А–Њ—Д–µ—Б—Б–Є–Њ–љ–∞–ї—М–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є. –Ю–њ–Є—Б—Л–≤–∞–µ–Љ–∞—П
—И–Ї–∞–ї–∞ –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ –Њ—Ж–µ–љ–Ї–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е
–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–µ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Ї–∞–ґ–і–Њ–Љ –Є–Ј
–њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е —Н—В–∞–њ–Њ–≤ –і–µ–Љ–µ–љ—Ж–Є–Є –Є –≤ —Ж–µ–ї–Њ–Љ
—Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –њ—А–Є–љ—П—В–Њ–Љ—Г –≤ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є
–≥–µ—А–Њ–љ—В–Њ–њ—Б–Є—Е–Є–∞—В—А–Є–Є –≤—Л–і–µ–ї–µ–љ–Є—О —Н—В–∞–њ–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П
–і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ (–ѓ.–С.–Ъ–∞–ї—Л–љ, 1990;
–Э.–Ф.–°–µ–ї–µ–Ј–љ–µ–≤–∞, 1990).
–Я–∞—А–∞–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ
–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.
–Э–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞
–љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Є–Ї (–Э.–Ъ.–Ъ–Њ—А—Б–∞–Ї–Њ–≤–∞ –Є
—Б–Њ–∞–≤—В., 1992) –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —А–∞—Б—И–Є—А–Є—В—М
–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤—Л—П–≤–ї–µ–љ–Є—П –Є –Њ—Ж–µ–љ–Ї–Є –≤—Л—Б—И–Є—Е –Ї–Њ—А–Ї–Њ–≤—Л—Е
—Д—Г–љ–Ї—Ж–Є–є, –њ–∞–Љ—П—В–Є –Є –Љ—Л—Б–ї–Є—В–µ–ї—М–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є
–њ–∞—Ж–Є–µ–љ—В–∞ —Г–ґ–µ –љ–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —А–∞–љ–љ–Є—Е —Н—В–∞–њ–∞—Е
–Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е –љ–µ—А–µ–і–Ї–Њ —Б–µ—А—М–µ–Ј–љ—Л–µ
–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ —В—А—Г–і–љ–Њ—Б—В–Є –≤ –Њ—В–≥—А–∞–љ–Є—З–µ–љ–Є–Є
–њ—А–Њ—П–≤–ї–µ–љ–Є–є –і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ –Њ—В
–≤–Њ–Ј—А–∞—Б—В–љ–Њ–≥–Њ –≤–Є–і–Њ–Є–Ј–Љ–µ–љ–µ–љ–Є—П
–Љ–љ–µ—Б—В–Є–Ї–Њ-–Є–љ—В–µ–ї–ї–µ–Ї—В—Г–∞–ї—М–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –Є–ї–Є –Њ—В –Є–љ—Л—Е
—Д–Њ—А–Љ —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –°—В—А—Г–Ї—В—Г—А–љ—Л–µ
–Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞
–љ–∞—А—Г—И–µ–љ–Є—П –≤—Л—Б—И–Є—Е –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є –Ї–∞–Ї –њ—А–Є
–±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞, —В–∞–Ї –Є –њ—А–Є —Б–µ–љ–Є–ї—М–љ–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ –Њ—Б–Њ–±–µ–љ–љ–Њ
–Њ—В—З–µ—В–ї–Є–≤–Њ –≤—Л—Б—В—Г–њ–∞—О—В –љ–∞ —Н—В–∞–њ–µ
—Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ —Б–ї–∞–±–Њ—Г–Љ–Є—П, –Ї–Њ–≥–і–∞
–Ј–∞–≤–µ—А—И–∞–µ—В—Б—П —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –њ—Б–Є—Е–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ
—Б–Є–љ–і—А–Њ–Љ–∞ –∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є —Б –Ї–Њ—А–Ї–Њ–≤—Л–Љ–Є
–Њ—З–∞–≥–Њ–≤—Л–Љ–Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞–Љ–Є.
–Ф–ї—П –љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±–Њ–ї—М–љ—Л—Е,
—Б—В—А–∞–і–∞—О—Й–Є—Е –і–µ–Љ–µ–љ—Ж–Є–µ–є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞,
–њ—А–Є–Љ–µ–љ—П–µ—В—Б—П —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–∞—П —Б—Е–µ–Љ–∞, —А–∞–Ј—А–∞–±–Њ—В–∞–љ–љ–∞—П
—И–Ї–Њ–ї–Њ–є –Р.–†. –Ы—Г—А–Є–Є, –љ–Њ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ –∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–љ–∞—П
–і–ї—П —В–∞–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е (–Ш.–§.–†–Њ—Й–Є–љ–∞, –У.–Р.–Ц–∞—А–Є–Ї–Њ–≤, 1998). –≠—В–∞
–Љ–µ—В–Њ–і–Є–Ї–∞ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ–Њ
–Њ—Ж–µ–љ–Є—В—М –љ–∞—А—Г—И–µ–љ–Є—П –њ–∞–Љ—П—В–Є, –Є–љ—В–µ–ї–ї–µ–Ї—В—Г–∞–ї—М–љ—Л—Е
–Њ–њ–µ—А–∞—Ж–Є–є –Є —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–Њ—А–Ї–Њ–≤—Л—Е —Д—Г–љ–Ї—Ж–Є–є: —А–µ—З–Є,
–њ—А–∞–Ї—Б–Є—Б–∞, –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –≥–љ–Њ–Ј–Є—Б–∞,
–Њ–њ—В–Є–Ї–Њ-–њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є, –∞ —В–∞–Ї–ґ–µ
–њ–Є—Б—М–Љ–∞, —З—В–µ–љ–Є—П, —Б—З–µ—В–∞ –Є –і—А.
–Ь–µ—В–Њ–і–Є–Ї–∞ –∞–љ–∞–ї–Є–Ј–∞ –і–∞–љ–љ—Л—Е –љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ
–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—Б–љ–Њ–≤–∞–љ–∞ –љ–∞ –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є –Р.–†. –Ы—Г—А–Є–Є (1973)
–Њ —Б–Є—Б—В–µ–Љ–љ–Њ–є –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –≤—Л—Б—И–Є—Е
–њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є –Є —Г—З–∞—Б—В–Є–Є —В—А–µ—Е –Њ—Б–љ–Њ–≤–љ—Л—Е
–±–ї–Њ–Ї–Њ–≤ –Љ–Њ–Ј–≥–∞ –≤ –Є—Е –Є–µ—А–∞—А—Е–Є—З–µ—Б–Ї–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є.
–£ –≤—Б–µ—Е –±–Њ–ї—М–љ—Л—Е —Б –і–µ–Љ–µ–љ—Ж–Є–µ–є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ
—В–Є–њ–∞ —Б—В—А—Г–Ї—В—Г—А–∞ –љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞
—Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–Њ—З–µ—В–∞–љ–Є–µ–Љ –љ–∞—А—Г—И–µ–љ–Є–є
–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є —А–µ–≥—Г–ї—П—В–Њ—А–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤,
–Ї–Њ—В–Њ—А—Л–µ –њ–Њ –Љ–µ—А–µ —Г—В—П–ґ–µ–ї–µ–љ–Є—П –і–µ–Љ–µ–љ—Ж–Є–Є –љ–∞—А–∞—Б—В–∞—О—В.
–Ю–і–љ–∞–Ї–Њ –±—Л–ї–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л –Є –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П
–Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е —Б —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –±–Њ–ї–µ–Ј–љ—М—О
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Є —Б–µ–љ–Є–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–µ–є
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞. –≠—В–Є —А–∞–Ј–ї–Є—З–Є—П
–Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П —А–∞–Ј–љ–Њ–є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В—М—О –≤
—Б—В—А—Г–Ї—В—Г—А–µ —Б–Є–љ–і—А–Њ–Љ–∞ –і–µ—Д–µ–Ї—В–Њ–≤ –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є
—А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–≥—Г–ї—П—В–Њ—А–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –∞ —В–∞–Ї–ґ–µ —А–∞–Ј–љ–Њ–є
–њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В—М—О –≤–Њ–≤–ї–µ—З–µ–љ–Є—П –≤
–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б —А–∞–Ј–ї–Є—З–љ—Л—Е
–Љ–Њ—А—Д–Њ—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Ј–Њ–љ –Љ–Њ–Ј–≥–∞ (–Э.–Ъ.–Ъ–Њ—А—Б–∞–Ї–Њ–≤–∞ –Є
—Б–Њ–∞–≤—В., 1991).
–£ –±–Њ–ї—М–љ—Л—Е —Б —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ –±–Њ–ї–µ–Ј–љ—М—О –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –љ–∞
—Н—В–∞–њ–µ —Г–Љ–µ—А–µ–љ–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є –≤ —Б—В—А—Г–Ї—В—Г—А–µ
–љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤
–Њ—Б–љ–Њ–≤–љ–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є—П –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е
—Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е –њ—Б–Є—Е–Є—З–µ—Б–Ї–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є
(–Њ–њ—В–Є–Ї–Њ-–њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є, –љ–Њ–Љ–Є–љ–∞—В–Є–≤–љ–Њ–є
—Д—Г–љ–Ї—Ж–Є–Є —А–µ—З–Є, –Ї–Є–љ–µ—Б—В–µ—В–Є—З–µ—Б–Ї–Њ–є –Є –Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–є
–Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –і–≤–Є–ґ–µ–љ–Є–є, –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –≥–љ–Њ–Ј–Є—Б–∞,
–њ–Є—Б—М–Љ–∞ –Є —З—В–µ–љ–Є—П), –Ї–Њ—В–Њ—А—Л–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В—Б—П –≤—В–Њ—А—Л–Љ
–±–ї–Њ–Ї–Њ–Љ –Љ–Њ–Ј–≥–∞, –∞ —В–∞–Ї–ґ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ
–Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Є –µ–µ –љ–µ–є—А–Њ–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е
–њ–∞—А–∞–Љ–µ—В—А–Њ–≤, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ–Љ—Л–µ –њ–µ—А–≤—Л–Љ –±–ї–Њ–Ї–Њ–Љ –Љ–Њ–Ј–≥–∞.
–Я—А–Є —Б–µ–љ–Є–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞
–љ–∞ –њ–µ—А–≤—Л–є –њ–ї–∞–љ –≤—Л—Б—В—Г–њ–∞—О—В –і–µ—Д–µ–Ї—В—Л –≤
—Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–Є —В—А–µ—В—М–µ–≥–Њ –±–ї–Њ–Ї–∞ –Љ–Њ–Ј–≥–∞:
–љ–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ–≥—А–∞–Љ–Љ–Є—А–Њ–≤–∞–љ–Є—П, –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ–Њ–є
—А–µ–≥—Г–ї—П—Ж–Є–Є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Є –Ї–Њ–љ—В—А–Њ–ї—П –Ј–∞ –µ–µ
–њ—А–Њ—В–µ–Ї–∞–љ–Є–µ–Љ, –∞ —В–∞–Ї–ґ–µ (–≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є) —Б–љ–Є–ґ–µ–љ–Є–µ
–∞–Ї—В–Є–≤–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Є –µ–µ
–і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ (–њ–µ—А–≤—Л–є –±–ї–Њ–Ї) –њ—А–Є
–Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є —Б–Њ—Е—А–∞–љ–љ–Њ—Б—В–Є –Њ–њ–µ—А–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е
—Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е (–≤—В–Њ—А–Њ–є –±–ї–Њ–Ї –Љ–Њ–Ј–≥–∞).
–£–Ї–∞–Ј–∞–љ–љ–∞—П –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ—Б—В—М —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ
—В–Њ–Љ, —З—В–Њ –њ–Њ –Љ–µ—А–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –і–µ–Љ–µ–љ—Ж–Є–Є –њ—А–Є
–±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б
–≤–Њ–≤–ї–µ–Ї–∞—О—В—Б—П —Б–љ–∞—З–∞–ї–∞ —В–µ–Љ–µ–љ–љ—Л–µ,
—В–µ–Љ–µ–љ–љ–Њ-–Ј–∞—В—Л–ї–Њ—З–љ—Л–µ –Є –≤–Є—Б–Њ—З–љ—Л–µ –Њ—В–і–µ–ї—Л –Љ–Њ–Ј–≥–∞ —Б
–њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ–Љ –µ–≥–Њ –љ–∞
–њ—А–µ—Д—А–Њ–љ—В–∞–ї—М–љ—Л–µ –Є –њ—А–µ–Љ–Њ—В–Њ—А–љ—Л–µ –Ј–Њ–љ—Л. –Я—А–Є —Б–µ–љ–Є–ї—М–љ–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–Є –≤–Њ–≤–ї–µ—З–µ–љ–Є–µ —Б—В—А—Г–Ї—В—Г—А –Љ–Њ–Ј–≥–∞ –≤
–±–Њ–ї–µ–Ј–љ–µ–љ–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –Њ—В
–њ–µ—А–µ–і–љ–Є—Е –Ї –Ј–∞–і–љ–Є–Љ –Њ—В–і–µ–ї–∞–Љ –Љ–Њ–Ј–≥–∞.
–Э–∞ —Н—В–∞–њ–µ –љ–∞—З–∞–ї—М–љ–Њ–є (–Љ—П–≥–Ї–Њ–є) –і–µ–Љ–µ–љ—Ж–Є–Є
–љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є—П –≤—Л—Б—И–Є—Е
–њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є –µ—Й–µ –љ–µ –њ–Њ–ї—Г—З–∞–µ—В —Б–≤–Њ–µ–є
–Ј–∞–≤–µ—А—И–µ–љ–љ–Њ—Б—В–Є.–Ю–і–љ–∞–Ї–Њ –Є –љ–∞ —Н—В–Њ–Љ —А–∞–љ–љ–µ–Љ —Н—В–∞–њ–µ
—А–∞–Ј–≤–Є—В–Є—П –і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞
–≤—Л—П–≤–ї—П—О—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ —Б—В—А—Г–Ї—В—Г—А–µ
–љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –љ–∞—А—Г—И–µ–љ–Є—П
–≤—Л—Б—И–Є—Е –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є, –њ–Њ–Љ–Њ–≥–∞—О—Й–Є–µ –≤
–і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞—Ж–Є–Є –µ–µ –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ (—Б–Љ.
—Б—В–∞—В—М—О –У.–Р.–Ц–∞—А–Є–Ї–Њ–≤–∞ –Є –Ш.–§.–†–Њ—Й–Є–љ–Њ–є –≤ —Н—В–Њ–Љ –ґ–µ
–љ–Њ–Љ–µ—А–µ).
–Э–µ–є—А–Њ–Є–љ—В—А–∞—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–µ
–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Э–∞–Є–±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є
–і–µ–Љ–µ–љ—Ж–Є–є –Љ–µ—В–Њ–і—Л CT –Є MRI. –≠—В–Є –Љ–µ—В–Њ–і—Л —П–≤–ї—П—О—В—Б—П
–Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –њ—А–Є
–Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±–Њ–ї—М–љ—Л—Е, —Б—В—А–∞–і–∞—О—Й–Є—Е –і–µ–Љ–µ–љ—Ж–Є–µ–є,
–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ–Њ—В–Њ–Љ—Г, —З—В–Њ —Н—В–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –і–∞–µ—В
–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞—В—М –Є–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П
–Є–ї–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В
–±—Л—В—М –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ —А–∞–Ј–≤–Є—В–Є–µ –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е
–љ–∞—А—Г—И–µ–љ–Є–є.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є –°–Ґ-–Љ–∞—А–Ї–µ—А–∞–Љ–Є, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—Й–Є–Љ–Є
–і–Є–∞–≥–љ–Њ–Ј –і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞,
—П–≤–ї—П—О—В—Б—П
–њ—А–Є–Ј–љ–∞–Ї–Є —Б—Г–Љ–Љ–∞—А–љ–Њ–є
–Є —А–µ–≥–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞—В—А–Њ—Д–Є–Є –≤–µ—Й–µ—Б—В–≤–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞,
—В.–µ. —Г–Љ–µ–љ—М—И–µ–љ–Є—П –Њ–±—К–µ–Љ–∞ –≤–µ—Й–µ—Б—В–≤–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞,
–Њ –љ–∞–ї–Є—З–Є–Є –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б—Г–і—П—В –њ–Њ –Є–љ–і–µ–Ї—Б–∞–Љ,
–Њ—Ж–µ–љ–Є–≤–∞—О—Й–Є–Љ —Б—В–µ–њ–µ–љ—М —А–∞—Б—И–Є—А–µ–љ–Є—П
—Б—Г–±–∞—А–∞—Е–љ–Њ–Є–і–∞–ї—М–љ—Л—Е –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤ –Є –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤–Њ–є
—Б–Є—Б—В–µ–Љ—Л –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –Њ–±—К–µ–Љ—Г –Љ–Њ–Ј–≥–Њ–≤–Њ–є —В–Ї–∞–љ–Є
—Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –і–Њ–ї–µ–є –Љ–Њ–Ј–≥–∞ (–Њ–±—К–µ–Љ–љ—Л–µ –Є–љ–і–µ–Ї—Б—Л), –∞
—В–∞–Ї–ґ–µ –њ–Њ –≤–µ–ї–Є—З–Є–љ–µ –ї–Є–љ–µ–є–љ—Л—Е –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤—Л—Е
–Є–љ–і–µ–Ї—Б–Њ–≤ (–њ–µ—А–µ–і–љ–Є—Е —А–Њ–≥–Њ–≤, —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤,
–Ј–∞–і–љ–Є—Е —А–Њ–≥–Њ–≤ –Є —В—А–µ—В—М–µ–≥–Њ –ґ–µ–ї—Г–і–Њ—З–Ї–∞).
–Ш–Ј—Г—З–µ–љ–Є–µ –њ—А–Є–ґ–Є–Ј–љ–µ–љ–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤
–≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –±–Њ–ї—М–љ—Л—Е —Б –і–µ–Љ–µ–љ—Ж–Є–µ–є
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ –љ–∞ —А–∞–Ј–љ—Л—Е —Н—В–∞–њ–∞—Е —В–µ—З–µ–љ–Є—П
–±–Њ–ї–µ–Ј–љ–Є –Є –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Ї–Њ–љ—В—А–Њ–ї—М–љ—Л–Љ–Є –≥—А—Г–њ–њ–∞–Љ–Є —Г
–ї–Є—Ж —В–Њ–≥–Њ –ґ–µ –≤–Њ–Ј—А–∞—Б—В–∞ –±–µ–Ј –Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є
–њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М —А—П–і
–Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ-—В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ
—Б –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Б—В–µ–њ–µ–љ—М—О –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є
–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А—Г—О—В –±–Њ–ї—М–љ—Л—Е –Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж
—Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (–Ш.–Т.–Ъ–Њ–ї—Л—Е–∞–ї–Њ–≤ –Є
—Б–Њ–∞–≤—В., 1993).
–Т —З–∞—Б—В–љ–Њ—Б—В–Є, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Є –њ—А–µ—Б–µ–љ–Є–ї—М–љ–Њ–Љ
—В–Є–њ–µ –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М
—А–µ–≥–Є–Њ–љ–∞–ї—М–љ–Њ–є –Ї–Њ—А–Ї–Њ–≤–Њ–є –Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –∞—В—А–Њ—Д–Є–Є (–≤
–њ—А–Њ–µ–Ї—Ж–Є—П—Е –≤–Є—Б–Њ—З–љ—Л—Е, –ї–Њ–±–љ—Л—Е –Є —В–µ–Љ–µ–љ–љ—Л—Е –і–Њ–ї–µ–є), –∞
—В–∞–Ї–ґ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –ї–Є–љ–µ–є–љ—Л—Е —А–∞–Ј–Љ–µ—А–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–Ї–Њ–≤
–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ—А–µ–≤—Л—И–∞—О—В –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є
–Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж —В–Њ–≥–Њ –ґ–µ –≤–Њ–Ј—А–∞—Б—В–∞.
–¶–µ–љ–љ–Њ—Б—В—М –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ-—В–Њ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е –і–ї—П
–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ—Ж–µ–љ–Ї–Є –±–Њ–ї—М–љ—Л—Е —Б–µ–љ–Є–ї—М–љ–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–µ–є –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–∞. –Я—А–Є —Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є
—Б–µ–љ–Є–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є –≤–µ–ї–Є—З–Є–љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є,
–Њ—Ж–µ–љ–Є–≤–∞—О—Й–Є—Е –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –∞—В—А–Њ—Д–Є–Є,
—Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В —В–∞–Ї–Њ–≤—Л—Е
—Г –≥—А—Г–њ–њ—Л –≤–Њ–Ј—А–∞—Б—В–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –њ–Њ –≤—Б–µ–Љ —Г–Ї–∞–Ј–∞–љ–љ—Л–Љ
–≤—Л—И–µ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ, –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –Њ–±—К–µ–Љ–љ—Л—Е
–≤–µ–љ—В—А–Є–Ї—Г–ї–Њ–і–Њ–ї–µ–≤—Л—Е –Є–љ–і–µ–Ї—Б–Њ–≤. –Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є,
–Њ—Ж–µ–љ–Є–≤–∞—О—Й–Є–µ —Б—В–µ–њ–µ–љ—М –Ї–Њ—А–Ї–Њ–≤–Њ–є –∞—В—А–Њ—Д–Є–Є, –Є–Љ–µ—О—В
–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ –Њ—В–ї–Є—З–Є–µ –Њ—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є
–≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –љ–Њ—А–Љ—Л —В–Њ–ї—М–Ї–Њ –і–ї—П –њ—А–Њ–µ–Ї—Ж–Є–Є
–Љ–µ–і–Є–Њ–±–∞–Ј–∞–ї—М–љ—Л—Е –Њ—В–і–µ–ї–Њ–≤ –≤–Є—Б–Њ—З–љ—Л—Е –і–Њ–ї–µ–є.
–Я—А–Є —Б–µ–љ–Є–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є –±—Л–ї–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞
–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї—М—И–∞—П —З–∞—Б—В–Њ—В–∞ –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М
–њ–Њ—А–∞–ґ–µ–љ–Є—П –±–µ–ї–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –≤
–њ–µ—А–Є–≤–µ–љ—В—А–Є–Ї—Г–ї—П—А–љ–Њ–є –Ј–Њ–љ–µ –Є –Њ–±–ї–∞—Б—В–Є —Б–µ–Љ–Є–Њ–≤–∞–ї—М–љ—Л—Е
—Ж–µ–љ—В—А–Њ–≤ (–ї–µ–є–Ї–Њ–∞—А–∞–Є–Њ–Ј–Є—Б) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є
–±–Њ–ї—М–љ—Л—Е, —Б—В—А–∞–і–∞—О—Й–Є—Е –њ—А–µ—Б–µ–љ–Є–ї—М–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞.
–Т –Ј–∞—А—Г–±–µ–ґ–љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А–µ (S.Fontain,
A.Nordberg, 1996) –њ—А–Є–≤–Њ–і–Є—В—Б—П —А—П–і –ї–Є–љ–µ–є–љ—Л—Е
–њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –°–Ґ/MRI, –Ї–Њ—В–Њ—А—Л–µ —В–∞–Ї–ґ–µ –Є–Љ–µ—О—В
–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –і–ї—П –Њ—В–≥—А–∞–љ–Є—З–µ–љ–Є—П
–±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Њ—В –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є: 1)
—Г–≤–µ–ї–Є—З–µ–љ–љ–Њ–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –љ–Њ—А–Љ–Њ–є
–Љ–µ–ґ–Ї—А—О—З–Ї–Њ–≤–Њ–µ (interuncal) —А–∞—Б—Б—В–Њ—П–љ–Є–µ; 2) —А–∞—Б—И–Є—А–µ–љ–Є–µ
–њ–µ—А–Є–≥–Є–њ–њ–Њ–Ї–∞–Љ–њ–∞–ї—М–љ—Л—Е —Й–µ–ї–µ–є; 3) —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞
–≥–Є–њ–њ–Њ–Ї–∞–Љ–њ–∞. –Я–Њ—Б–ї–µ–і–љ–Є–є –њ—А–Є–Ј–љ–∞–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј —А–∞–љ–љ–Є—Е
–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤.
–£–Ї–∞–Ј—Л–≤–∞—О—В —В–∞–Ї–ґ–µ –љ–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М
–Љ–µ—В–Њ–і–Њ–≤, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е –њ–Њ–ї—Г—З–Є—В—М —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ
—Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –Љ–Њ–Ј–≥–Њ–≤—Л—Е —Б—В—А—Г–Ї—В—Г—А. –°—А–µ–і–Є
–љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –њ—А–Є–≤–Њ–і—П—В
—Б–ї–µ–і—Г—О—Й–Є–µ: 1) –±–Є–ї–∞—В–µ—А–∞–ї—М–љ–Њ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞
–≤ –≤–Є—Б–Њ—З–љ–Њ-—В–µ–Љ–µ–љ–љ—Л—Е –Њ—В–і–µ–ї–∞—Е –Ї–Њ—А—Л, –њ–Њ –і–∞–љ–љ—Л–Љ SPECT; 2)
–∞—В—А–Њ—Д–Є—П –≤–Є—Б–Њ—З–љ—Л—Е –і–Њ–ї–µ–є –Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤
–≤–Є—Б–Њ—З–љ–Њ-—В–µ–Љ–µ–љ–љ—Л—Е –Њ—В–і–µ–ї–∞—Е –Ї–Њ—А—Л, –њ–Њ –і–∞–љ–љ—Л–Љ CT –Є SPECT.
–Э–µ–є—А–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ
–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
–Э–µ–є—А–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ј–∞–љ–Є–Љ–∞—О—В
–Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ–µ–µ –Ј–љ–∞—З–Є–Љ–Њ–µ –Љ–µ—Б—В–Њ —Б—А–µ–і–Є
–љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ—Ж–µ–љ–Ї–Є
–±–Њ–ї—М–љ—Л—Е –і–µ–Љ–µ–љ—Ж–Є—П–Љ–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞.
–≠–ї–µ–Ї—В—А–Њ—Н–љ—Ж–µ—Д–∞–ї–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–µ (–≠–≠–У) –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ:
–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –≠–≠–У-–Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ—А–Є –і–µ–Љ–µ–љ—Ж–Є—П—Е
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ –Њ—В–Љ–µ—З–∞—О—В—Б—П —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞
–±–Њ–ї—М–љ—Л—Е. –Э–∞–Є–±–Њ–ї–µ–µ —В–Є–њ–Є—З–љ—Л: –љ–∞—А–∞—Б—В–∞–љ–Є–µ
–Љ–µ–і–ї–µ–љ–љ–Њ-–≤–Њ–ї–љ–Њ–≤–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є (–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ
–µ–µ q-–і–Є–∞–њ–∞–Ј–Њ–љ–∞, —З–∞—Й–µ –љ–Є–Ј–Ї–Њ–є –Є–ї–Є —Б—А–µ–і–љ–µ–є –∞–Љ–њ–ї–Є—В—Г–і—Л)
–Є D-–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –∞ —В–∞–Ї–ґ–µ —А–µ–і—Г–Ї—Ж–Є—П
a-—А–Є—В–Љ–∞ –≤ –≤–Є–і–µ —Б–љ–Є–ґ–µ–љ–Є—П –µ–≥–Њ –∞–Љ–њ–ї–Є—В—Г–і—Л
–Є —Б–≥–ї–∞–ґ–µ–љ–љ–Њ—Б—В–Є —А–µ–≥–Є–Њ–љ–∞–ї—М–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –њ–Њ
—Б—А–∞–≤–љ–µ–љ–Є—О —Б –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –љ–Њ—А–Љ–Њ–є. –Т—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М b-–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –Ї–∞–Ї
–њ—А–∞–≤–Є–ї–Њ, –±—Л–ї–∞ —Б–љ–Є–ґ–µ–љ–∞. –Ф–Њ–≤–Њ–ї—М–љ–Њ —З–∞—Б—В–Њ (—Г —В—А–µ—В–Є
–±–Њ–ї—М–љ—Л—Е) –љ–∞–±–ї—О–і–∞—О—В—Б—П –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–µ
–±–Є–ї–∞—В–µ—А–∞–ї—М–љ–Њ-—Б–Є–љ—Е—А–Њ–љ–љ—Л–µ q- –Є D-–≤–Њ–ї–љ—Л, –њ—А–µ–≤—Л—И–∞—О—Й–Є–µ
–њ–Њ –∞–Љ–њ–ї–Є—В—Г–і–µ –Њ—Б–љ–Њ–≤–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М (–Э.–Т.–Я–Њ–љ–Њ–Љ–∞—А–µ–≤–∞
–Є —Б–Њ–∞–≤—В., 1991).
–Ф–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–∞—П —Ж–µ–љ–љ–Њ—Б—В—М —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –≤—Л—И–µ
–≠–≠–У-–Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–µ–Њ–і–љ–Њ–Ј–љ–∞—З–љ–∞. –Я–Њ –Љ–љ–µ–љ–Є—О
–±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤, –љ–∞–Є–±–Њ–ї—М—И–µ–є
–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В—М—О –Њ–±–ї–∞–і–∞–µ—В
—В–∞–Ї–Њ–є –њ—А–Є–Ј–љ–∞–Ї, –Ї–∞–Ї –љ–∞—А–∞—Б—В–∞–љ–Є–µ
–Љ–µ–і–ї–µ–љ–љ–Њ-–≤–Њ–ї–љ–Њ–≤–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, —Б—В–µ–њ–µ–љ—М –µ–≥–Њ
–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 68 –і–Њ 91%.
–≠–≠–У-–Ї–∞—А—В–Є—А–Њ–≤–∞–љ–Є–µ вАУ –Љ–µ—В–Њ–і –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–≥–Њ
–∞–љ–∞–ї–Є–Ј–∞ –Є –Њ—В–Њ–±—А–∞–ґ–µ–љ–Є—П –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ–є
–Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ
–Љ–Њ–Ј–≥–∞ (—В–Њ–њ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–µ –≠–≠–У-–Ї–∞—А—В–Є—А–Њ–≤–∞–љ–Є–µ).
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –≠–≠–У-–Ї–∞—А—В–Є—А–Њ–≤–∞–љ–Є—П –њ—А–Є –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ
–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Ї–Њ–≥–Њ—А—В—Л –±–Њ–ї—М–љ—Л—Е —Б –і–µ–Љ–µ–љ—Ж–Є—П–Љ–Є
–∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ
–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г—Б–Є–ї–µ–љ–Є–µ –Љ–µ–і–ї–µ–љ–љ–Њ-–≤–Њ–ї–љ–Њ–≤–Њ–є –Є
–Њ—Б–Њ–±–µ–љ–љ–Њ D-–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —П–≤–ї—П–µ—В—Б—П —В–µ–Љ
–≠–≠–У-–њ–∞—А–∞–Љ–µ—В—А–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –љ–∞–і–µ–ґ–љ–Њ –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б
–і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –і–µ–Љ–µ–љ—Ж–Є–Є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞
(–Р.–§.–Ш–Ј–љ–∞–Ї –Є —Б–Њ–∞–≤—В., 1991, 1999). –Я—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –≥—А—Г–њ–њ
–±–Њ–ї—М–љ—Л—Е —Б –±–Њ–ї–µ–Ј–љ—М—О –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –Є —Б–µ–љ–Є–ї—М–љ–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–µ–є –∞–ї—М—Ж–≥–µ–є–Љ–µ—А–Њ–≤—Б–Ї–Њ–≥–Њ —В–Є–њ–∞ —Б –Є–і–µ–љ—В–Є—З–љ–Њ–є
—В—П–ґ–µ—Б—В—М—О —Б–Є–љ–і—А–Њ–Љ–∞ –і–µ–Љ–µ–љ—Ж–Є–Є –±—Л–ї–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л
—А–∞–Ј–ї–Є—З–љ–∞—П —В–Њ–њ–Њ–≥—А–∞—Д–Є—П —Б–њ–µ–Ї—В—А–∞–ї—М–љ–Њ–є –≠–≠–У-–Љ–Њ—Й–љ–Њ—Б—В–Є
–Є —А–∞–Ј–ї–Є—З–љ—Л–µ —В–µ–љ–і–µ–љ—Ж–Є–Є –µ–µ –і–Є–љ–∞–Љ–Є–Ї–Є –њ–Њ –Љ–µ—А–µ
—Г—В—П–ґ–µ–ї–µ–љ–Є—П —Б–Є–љ–і—А–Њ–Љ–∞ –і–µ–Љ–µ–љ—Ж–Є–Є.
–Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–Є –±–Њ–ї–µ–Ј–љ–Є –Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞ –љ–∞ —Н—В–∞–њ–µ
—Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —А–µ–Ј–Ї–Њ–µ
—Б–љ–Є–ґ–µ–љ–Є–µ —Б–њ–µ–Ї—В—А–∞–ї—М–љ–Њ–є –Љ–Њ—Й–љ–Њ—Б—В–Є –≤ a-–і–Є–∞–њ–∞–Ј–Њ–љ–µ —Б
–љ–∞–Є–±–Њ–ї—М—И–Є–Љ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ–Љ –≤—Л—Б–Њ–Ї–Њ—З–∞—Б—В–Њ—В–љ—Л—Е
–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ a-—А–Є—В–Љ–∞. –Т q-—З–∞—Б—В–Њ—В–љ–Њ–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–µ
–Њ—В–Љ–µ—З–∞–µ—В—Б—П –Ј–∞–Љ–µ—В–љ–Њ–µ –і–Є—Д—Д—Г–Ј–љ–Њ–µ —Г—Б–Є–ї–µ–љ–Є–µ –Љ–Њ—Й–љ–Њ—Б—В–Є
(–њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –љ–Њ—А–Љ–Њ–є) –≤–Њ –≤—Б–µ—Е
–Њ—В–і–µ–ї–∞—Е –Љ–Њ–Ј–≥–∞ —Б –њ–Є–Ї–Њ–Љ –≤ —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –Њ—В–≤–µ–і–µ–љ–Є—П—Е.
–†–∞—Б—В–µ—В –Є —Б–њ–µ–Ї—В—А–∞–ї—М–љ–∞—П –Љ–Њ—Й–љ–Њ—Б—В—М –≤ D-—З–∞—Б—В–Њ—В–љ–Њ–Љ
–і–Є–∞–њ–∞–Ј–Њ–љ–µ, –њ–Є–Ї –µ–µ –Љ–Њ—Й–љ–Њ—Б—В–Є –њ—А–Є—Е–Њ–і–Є—В—Б—П –љ–∞
–ї–Њ–±–љ–Њ-—Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –Њ–±–ї–∞—Б—В–Є. –Э–∞ —Б—В–∞–і–Є–Є —В—П–ґ–µ–ї–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ–Њ–ї–љ–Њ–µ –≤—Л–њ–∞–і–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ- –Є
—Б—А–µ–і–љ–µ—З–∞—Б—В–Њ—В–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ a-–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є.
–Ь–Њ—Й–љ–Њ—Б—В—М –≤ q- –Є D-—З–∞—Б—В–Њ—В–љ–Њ–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–µ, –љ–∞–њ—А–Њ—В–Є–≤,
—Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—П—Б—М –≥–µ–љ–µ—А–∞–ї–Є–Ј–∞—Ж–Є–µ–є –Є–Ј
—Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –Њ–±–ї–∞—Б—В–µ–є –≤ —В–µ–Љ–µ–љ–љ—Л–µ –Є –ї–Њ–±–љ—Л–µ –Њ—В–і–µ–ї—Л.
–Т –≥—А—Г–њ–њ–µ –±–Њ–ї—М–љ—Л—Е —Б–µ–љ–Є–ї—М–љ–Њ–є –і–µ–Љ–µ–љ—Ж–Є–µ–є (–љ–∞ —Б—В–∞–і–Є–Є
—Г–Љ–µ—А–µ–љ–љ–Њ–≥–Њ —Б–ї–∞–±–Њ—Г–Љ–Є—П) –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ
a-—А–Є—В–Љ–∞ –≤ –Ј–∞—В—Л–ї–Њ—З–љ–Њ–є –Њ–±–ї–∞—Б—В–Є, —Д–Њ–Ї—Г—Б –µ–≥–Њ
—Б–њ–µ–Ї—В—А–∞–ї—М–љ–Њ–є –Љ–Њ—Й–љ–Њ—Б—В–Є (–Њ—Б–Њ–±–µ–љ–љ–Њ –љ–Є–Ј–Ї–Њ—З–∞—Б—В–Њ—В–љ–Њ–≥–Њ
–Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞) —Б–Љ–µ—Й–∞–µ—В—Б—П –≤ —В–µ–Љ–µ–љ–љ–Њ-—Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ
–Њ–±–ї–∞—Б—В–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Б–Љ–µ—Й–µ–љ–Є–µ
–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –Љ–Њ—Й–љ–Њ—Б—В–Є –≤ q- –Є D-—З–∞—Б—В–Њ—В–љ–Њ–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–µ
–≤ —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –Є —В–µ–Љ–µ–љ–љ—Л–µ –Њ–±–ї–∞—Б—В–Є. –Я–Њ –Љ–µ—А–µ
—Г—В—П–ґ–µ–ї–µ–љ–Є—П –і–µ–Љ–µ–љ—Ж–Є–Є D-–∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–µ–љ–µ—А–∞–ї–Є–Ј—Г–µ—В—Б—П,
–∞ –µ–µ —Д–Њ–Ї—Г—Б —Б–і–≤–Є–≥–∞–µ—В—Б—П –Є–Ј –ї–Њ–±–љ—Л—Е –≤
—В–µ–Љ–µ–љ–љ–Њ-–Ј–∞—В—Л–ї–Њ—З–љ—Л–µ –Њ–±–ї–∞—Б—В–Є. –Т a-—З–∞—Б—В–Њ—В–љ–Њ–Љ
–і–Є–∞–њ–∞–Ј–Њ–љ–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ–µ—А–µ—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ
–Љ–Њ—Й–љ–Њ—Б—В–Є —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ—З–∞—Б—В–Њ—В–љ—Л—Е –љ–∞ –Љ–µ–љ–µ–µ
–≤—Л—Б–Њ–Ї–Њ—З–∞—Б—В–Њ—В–љ—Л–µ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В—Л –њ—А–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є
—Б–Њ—Е—А–∞–љ–љ–Њ—Б—В–Є –њ–Њ—Б–ї–µ–і–љ–Є—Е –і–∞–ґ–µ –љ–∞ —Н—В–∞–њ–µ —В—П–ґ–µ–ї–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–Є.

|
–°–њ–Є—Б–Њ–Ї
–Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–Њ–є –ї–Є—В–µ—А–∞—В—Г—А—Л
1. –У–∞–≤—А–Є–ї–Њ–≤–∞ –°.–Ш. –Я—Б–Є—Е–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –≤
–љ–∞—Б–µ–ї–µ–љ–Є–Є –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞
(–Ї–ї–Є–љ–Є–Ї–Њ-—Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–µ –Є
–Ї–ї–Є–љ–Є–Ї–Њ-—Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ)//–Ф–Є—Б—Б.
...–і–Њ–Ї—В. –Љ–µ–і. –љ–∞—Г–Ї. –Ь., 1984; 403.
2. –Ъ–∞–ї—Л–љ –ѓ.–С. –Ъ–ї–Є–љ–Є–Ї–∞ –Є–љ–Є—Ж–Є–∞–ї—М–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Є
–Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ —В–µ—З–µ–љ–Є—П —Б–µ–љ–Є–ї—М–љ–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–Є//–Ф–Є—Б. ...–Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. –Ь., 1990; 220.
3. –Ы—Г—А–Є—П –Р.–†. –Ю—Б–љ–Њ–≤—Л –љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є–Є. –Ь., –Ш–Ј–і-–≤–Њ –Ь–У–£
1973; 374.
4. –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –±–Њ–ї–µ–Ј–љ–µ–є, 10-–є
–њ–µ—А–µ—Б–Љ–Њ—В—А (–Ь–Ъ–С-10). –Я–µ—А. –њ–Њ–і —А–µ–і. –Э—Г–ї–ї–µ—А–∞ –Ѓ.–Ы. –Є
–¶–Є—А–Ї–Є–љ–∞ –°.–Ѓ. –°–Я–±. 1994; 303.
5. –†–Њ—Й–Є–љ–∞ –Ш.–§. –°—В—А—Г–Ї—В—Г—А–∞ –Є –і–Є–љ–∞–Љ–Є–Ї–∞
–љ–µ–є—А–Њ–њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ—А–Є —Б–µ–љ–Є–ї—М–љ–Њ–є
–і–µ–Љ–µ–љ—Ж–Є–Є. –Ф–Є—Б. ...–Ї–∞–љ–і. –њ—Б–Є—Е–Њ–ї. –љ–∞—Г–Ї. –Ь., 1993; 220.
6. –°–µ–ї–µ–Ј–љ–µ–≤–∞ –Э.–Ф. –°—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ-–≤–Њ–Ј—А–∞—Б—В–љ—Л–µ
–Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Ї–ї–Є–љ–Є–Ї–Є –Є —В–µ—З–µ–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є
–Р–ї—М—Ж–≥–µ–є–Љ–µ—А–∞//–Ф–Є—Б—Б. вА¶–Ї–∞–љ–і. –Љ–µ–і. –љ–∞—Г–Ї. –Ь, 1990; 213.
7. –®—В–µ—А–љ–±–µ—А–≥ –≠.–ѓ. –Ъ–ї–Є–љ–Є–Ї–∞ –і–µ–Љ–µ–љ—Ж–Є–є –њ—А–µ—Б–µ–љ–Є–ї—М–љ–Њ–≥–Њ
–≤–Њ–Ј—А–∞—Б—В–∞. –Ь.: –Ь–µ–і–Є—Ж–Є–љ–∞, 1967; 247.
8. Braak H., Braak E. The human enthorinal cortex: normal morphology and lamina-specific
pathology in various diseases.//Neurosci Res 1991; 15: 6вАУ31.
9. McKhann G., Drachman D., Folstein M., et al. Clinical diagnosis of Alzheimer`s disease:
report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human
Services Task Force on Alzheimer`s disease//Neurology 1984; 146: 939вАУ44.
|
–Ш—Б—В–Њ—З–љ–Є–Ї: http://www.nedug.ru/lib/lit/psych/01oct/psych60/psych.htm
–Я–Њ–і–±–Њ—А–Ї–∞ –Є–ї–ї—О—Б—В—А–∞—Ж–Є–є –љ–∞—И–∞, —А–µ–і. –њ–Њ—А—В–∞–ї–∞

|
–Ч–∞–Ї–∞–Ј –љ–∞ —Г—Б–ї—Г–≥–Є
–і–Њ–Љ—А–∞–±–Њ—В–љ–Є—Ж, –љ—П–љ—М, –≥—Г–≤–µ—А–љ–µ—А–Њ–≤, —Б–Є–і–µ–ї–Њ–Ї,
–њ–Њ–≤–∞—А–Њ–≤, —Е–Њ–Ј—П–µ–Ї –Њ—Д–Є—Б–Њ–≤,
–Љ—Л—В—М–µ –Њ–Ї–Њ–љ (–≤ —В.—З. –∞–ї—М–њ–Є–љ–Є—Б—В–∞–Љ–Є), —Г—Е–Њ–і
–Ј–∞ —Б–∞–і–Њ–Љ, –ґ–Є–≤–Њ—В–љ—Л–Љ–Є, –≤—Л–≥—Г–ї —Б–Њ–±–∞–Ї
—А–µ–њ–µ—В–Є—В–Њ—А–Њ–≤ (–њ–Њ –≤—Б–µ–Љ –њ—А–µ–і–Љ–µ—В–∞–Љ),
–њ—Б–Є—Е–Њ–ї–Њ–≥–Њ–≤, –ї–Њ–≥–Њ–њ–µ–і–Њ–≤, —В–∞–Љ–∞–і—Л;
–≤—Л –Љ–Њ–ґ–µ—В–µ —Б–і–µ–ї–∞—В—М –њ–Њ —В–µ–ї.:
+7 (812) 752-66-70, —В\—Д–∞–Ї—Б +7 (812) 756-98-37, –ї–Є–±–Њ –њ–Њ
—Н–ї–µ–Ї—В—А–Њ–љ–љ–Њ–є –њ–Њ—З—В–µ Sirine@mail.ru
–Ъ–Њ–Љ–њ–∞–љ–Є—П
–Њ—В–Ї—А—Л—В—Л—Е —Б–Є—Б—В–µ–Љ
–Ю—Б–љ–Њ–≤–∞–љ–∞ –≤ 1989–≥.
–°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥
|
.
–Ґ–Њ–ї—М–Ї–Њ
–њ–Њ–і–њ–Є—Б–Ї–∞ –≥–∞—А–∞–љ—В–Є—А—Г–µ—В –Т–∞–Љ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –њ–Њ–ї—Г—З–µ–љ–Є–µ
–Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –Њ –љ–Њ–≤–Є–љ–Ї–∞—Е –і–∞–љ–љ–Њ–≥–Њ —А–∞–Ј–і–µ–ї–∞
–Э—Г–ґ–љ–Њ–µ: –£—Б–ї—Г–≥–Є –љ—П–љ—М
–Ъ–Њ–ї–ї–µ–Ї—Ж–Є–Њ–љ–љ—Л–µ –Ї—Г–Ї–ї—Л
–£–±–Њ—А–Ї–∞, –Љ—Л—В—М–µ –Њ–Ї–Њ–љ
Copyright ¬© –Ъ–Ю–Ь–Я–Р–Э–Ш–ѓ
–Ю–Ґ–Ъ–†–Ђ–Ґ–Ђ–• –°–Ш–°–Ґ–Х–Ь. –Т—Б–µ –њ—А–∞–≤–∞ —Б–Њ—Е—А–∞–љ—П—О—В—Б—П.
–Я–Њ—Б–ї–µ–--webbot bot="TimeStamp"
s-format="%B %d, %Y %H:%M:%S" s-ty–≤–∞—А—П 21, 2012 22:55:35.


